近期,我校生物工程学院饶义剑教授团队在解析尾孢菌素生物合成中七元亚甲基二氧桥环的形成机制方面取得了重要进展,研究成果“Molecular Basis of the Unusual Seven-membered Methylenedioxy Bridge Formation Catalyzed by Fe(II)/α-KG-dependent Oxygenase CTB9”在线发表于ACS Catalysis (Q1,IF = 13.084) (https://doi.org/10.1021/acscatal.1c04627)。
天然产物由于其广泛的生物活性和显著的结构多样性,在新药挖掘中发挥着重要作用。此外,通过对天然产物的生物合成途径解析不仅可以挖掘新酶催化反应,也为合成更多功能性天然产物衍生物提供了坚实的理论基础。亚甲基二氧桥环是一类非常重要的结构单元,广泛存在于具有抗菌、抗病毒、抗癌等多种生物活性的天然产物和药物分子中。如含有七元亚甲基二氧桥环的尾孢菌素(cercosporin),是一种典型的苝醌类色素,具有多种重要的生物活性和优异的光催化活性。尽管尾孢菌素已被分离鉴定了几十年,但其生物合成途径,特别是独特的七元亚甲基二氧桥环的形成过程仍不明确。
基于前期的研究基础(Zhou, et al, 2021,Microb Cell Fact),首先,通过基因敲除和体外重构验证了催化尾孢菌素中七元亚甲基二氧桥环形成的关键酶是α-酮戊二酸(α-KG)依赖的双加氧酶CTB9(图1)。其次,为了揭示CTB9的催化机理,解析了CTB9在催化过程中三种不同状态的蛋白质晶体Se-CTB9 (2.29 Å, 7EUS)、CTB9•Cu•NOG (2.49 Å, 7EUT)和CTB9•Cu•NOG•pre-cercosporin (2.20 Å, 7EUU) (图2),获得了CTB9与底物pre-cercosporin的结合方式,经过定点突变验证了关键氨基酸残基在CTB9催化过程中起着关键作用。为了进一步揭示CTB9在催化合成尾孢菌素中七元亚甲基二氧桥环的机理,结合量子化学计算,发现底物pre-cercosporin在经过Fe离子的变价形成[pre-cercosporin/O=Fe(IV)]过渡态后,可能有经历两种途径转化为产物cercosporin。然而途径2的活化能垒明显低于途径1,为此,本研究清晰地阐明了尾孢菌素生物合成途径中七元亚甲基二氧桥环的形成机制,为解析更多含有亚甲基二氧桥环的天然产物的合成途径提供了重要的分子和理论基础。
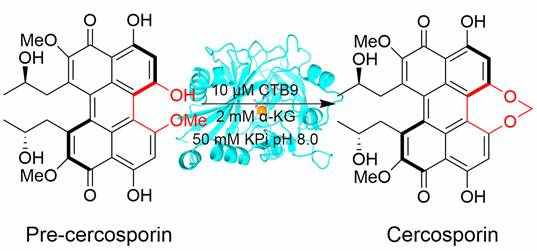
图1. CTB9体外催化pre-cercosporin转化为cercosporin
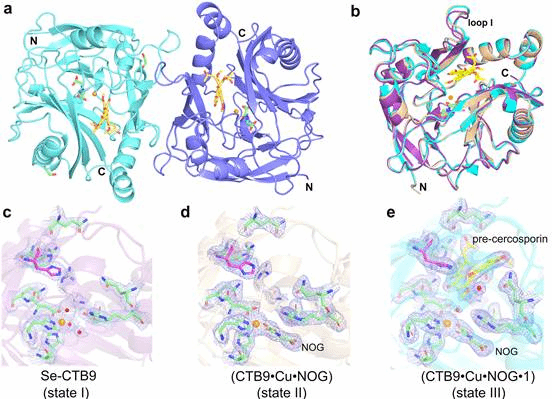
图2.CTB9、CTB9•Cu•NOG、CTB9•Cu•NOG•pre-cercosporin的晶体结构
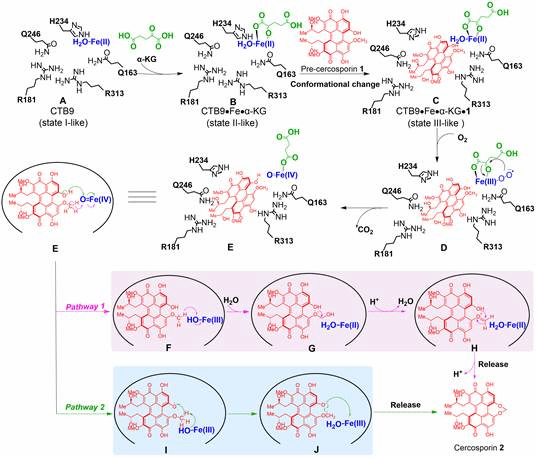
图3 CTB9催化生成七元亚甲基二氧桥环的机理
2019级硕士生刘旋忠、袁振波助理研究员、2018级博士生侯晓冬、中科院天工所的苏浩为该论文的共同第一作者,饶义剑教授和中科院天津工业生物技术研究所的盛翔教授为该论文的共同通讯作者。上述研究工作得到了国家重点研发计划(2018YFA0901700),江苏省自然科学基金(BK20202002),中央高校基本科研业务费专项资金(JUSRP12015),中国博士后基金(2020M671329),江苏省博士后科研基金计划项目(2020Z383)以及生物工程学院青年人才托举工程等基金资助。
