微生物细胞工厂能以经济、绿色环保的形式将廉价底物转换为高价值产品,如精细化学品、生物能源、天然产物、生物药物等。然而,有毒或易挥发中间代谢物的泄漏,降低了微生物细胞工厂的转化效率。因此,将代谢路径关键酶定位于天然细胞器可以提供有利的化学环境并封存有毒化合物。然而,由于天然细胞器的渗透性和数量有限,仍然难以进一步提高化学品合成效率。近期,我校刘立明教授团队,以无膜细胞器为研究对象,基于蛋白组装构建了一种材料属性可调的无膜细胞器,用于辅助微生物细胞工厂生产化学品。该研究成果“Engineered Artificial Membraneless Organelles inSaccharomyces cerevisiaeTo Enhance Chemical Production”正式发表于Angewandte Chemie International Edition(IF = 16.823)(https://doi.org/10.1002/anie.202215778)。
作者筛选了形成无膜细胞器的无序蛋白结构域,评估了A-IDPs在液滴饱和度、温度稳定性和细胞生长方面具有的优势,最后在酿酒酵母中构建了稳定且高效的无膜细胞器。
为了改变蛋白液滴大小,作者构建了一系列不同长度的A-IDPs结构域(0.5 A-IDPs、1.0 A-IDPs、1.5 A-IDPs、2.0 A-IDPs)并将其在酿酒酵母中进行表达,发现:(1)随着A-IDPs结构域长度的增加,形成蛋白液滴的细胞比例从19.9%(0.5 A-IDPs)增加到89.7%(2.0 A-IDPs); (2)液滴平均直径从0.36 μm (0.5 A-IDPs)提高到2.6 μm (2.0 A-IDPs)。
为了改变蛋白液滴的刚性,将朊病毒结构域(sPFD)融合到A-IDPs,形成重组sPFD-A-IDPs,并在体外对比分析了sPFD、A-IDPs和sPFD-A-IDPs形成的蛋白液滴荧光漂白恢复(FRAP)程度,发现sPFD和sPFD-A-IDPs荧光恢复程度比A-IDPs分别下降了44.9%和40.1%。接下来,将sPFD-GFP、A-IDPs-GFP和sPFD-A-IDPs-GFP融合蛋白表达于酿酒酵母中并形成蛋白液滴,将蛋白液滴与10%的1,6-己二醇一起孵育,发现A-IDPs-GFP迅速溶解,而sPFD-GFP和sPFD-A-IDPs-GFP的液滴仅仅溶解了0.6%和8.8%。
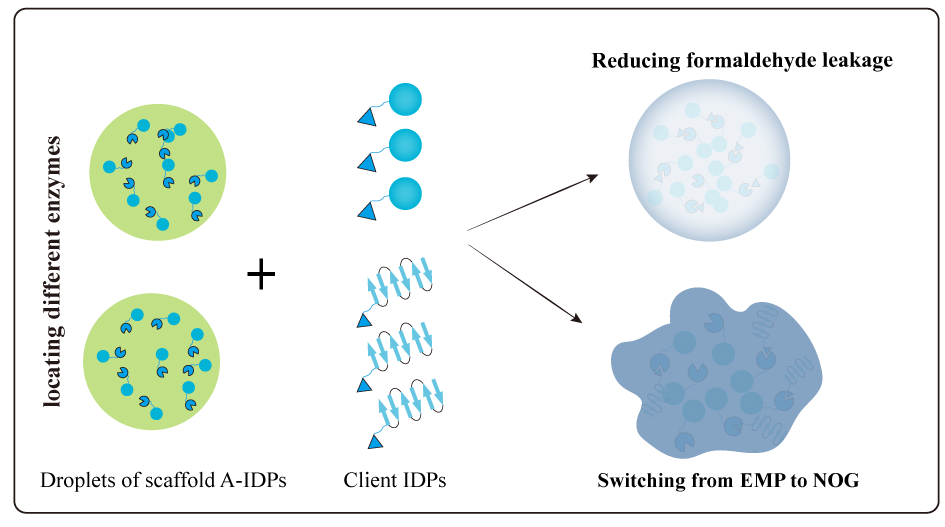
为了使细胞根据需要调整液滴的大小和刚性,构建液滴性质调节开关(CPRS),主要由蛋白组装模块和蓝光激活模块组成。其工作原理是融合有蛋白互作标签的客户蛋白在蓝光响应启动子的控制下启动表达,然后在高亲和力二聚化标签(P3-P4)作用下,客户蛋白被强制定位到液滴支架(P3-A-IDPs-mKate)中,从而达到调整液滴性质的目的。
作者在利用酵母细胞同化甲醇的过程中发现,稳定期细胞中约有21.7%的细胞死亡率,其原因是RuMP路径的中间代谢物甲醛积累量达到68.3 μM,导致了细胞毒性。为了进一步提高甲醇的同化能力,减少甲醛毒性对细胞的伤害,作者通过调控酿酒酵母工程菌株ZP03-FM(包含甲醇同化路径和苹果酸合成路径)中甲醇同化无膜细胞器的尺寸,降低甲醛的泄露,使得甲醇消耗量和苹果酸产量分别提高了162%和61%。
乙酰辅酶a是多种重要化合物的代谢前体,通常通过丙酮酸脱羧产生,因此不可避免的会造成碳损失。为了避免乙酰辅酶a合成过程中的碳损失,过表达来源双岐杆菌的磷酸酮醇酶(xfspk)和来源克氏梭菌的磷酸转乙酰化酶(Pta),构建了非氧化糖酵解路径。在此此基础上,敲除6-磷酸果糖激酶(PFK1/2)和磷酸水解酶(GPP1),使碳通量由氧化糖酵解转向非氧化糖酵解,形成了一条可以减少碳损失且增加乙酰辅酶a供应的代谢路径。然而,该工程菌株的生长速率降低了43.6%,其原因可能是非氧化糖酵解不能为细胞生长提供足够的能量。为解除这一限制,作者在酿酒酵母工程菌株ZP04-RB中调节了糖酵解无膜细胞器的刚性。在生产阶段,使乙酰辅酶a的合成从氧化性糖酵解切换为非氧化性糖酵解,最终使二氧化碳的释放量减少了35%,正丁醇的产率增加了20%。
该工作在全面了解无膜细胞器形成机制的基础上,设计高效合理的调控工具来调节无膜细胞器的物理特性,使无膜细胞器应用于化学品的合成,为设计高性能工业菌株提供了一种新的策略。
刘立明教授为论文的通讯作者,我校2018级博士生周配为第一作者。上述研究得到了国家自然科学基金重点项目(22038005)、国家重点研发计划项目(2020YFA0908500)、江苏省前沿引领技术基础研究专项项目(BK20212013)的资助。
近年来,刘立明课题组致力于解析生物加工过程中生物体(微生物/酶)的生理特性和调控机制,发展强化生产性能的新技术和新方法,以创建新一代工业菌株和性能先进的酶制剂,提升生物制造过程的效能,实现生物技术产品的低成本制造。在Nat Catal、Nat Commun、Chem Rev、Metab Eng、Green Chem、微生物学报、生物工程学报等国内外生物工程类主流学术期刊上发表学术论文260余篇,授权发明专利70余项、出版科技著作4部。
