近日,Nucleic Acids Research发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队刘龙教授课题组的研究成果“CRISPR/Cas13X-assisted programmable and multiplexed translation regulation for controlled biosynthesis”(Xu et al., Nucleic Acids Res., 2025, 53: gkae1293)。徐显皓助理研究员为第一作者,刘龙教授为论文通讯作者。
目前,国际上已开发了多种基因表达调控工具用于精细调节细胞工厂的代谢流,从而提高目标产物的合成效率。在众多代谢调控工具中,CRISPR-Cas系统因其能够同时激活和抑制基因的表达,且具有高精度、多功能性和可编程性强的优点,应用最为广泛。其中研究最多的为Cas9和Cas12a系统,然而,它们只能在转录水平上调节基因表达。与转录调控相比,翻译调控响应速率更快,并可独立调控细菌多顺反子中各个基因的表达。Cas13系统是一类靶向RNA,能够在翻译水平调控基因表达的CRISPR-Cas13系统。然而,基于Cas13系统所开发的表达调控工具仍然较少,且存在调控效果较差的问题。
针对以上问题,该研究基于高保真的hfCas13X系统,在枯草芽孢杆菌(Bacillus subtilis)设计和构建了能够在翻译水平调控基因表达的CRISPRi/a(抑制/激活)系统(图1)。首先,测试了hfCas13X在B. subtilis中的功能,通过将crRNA靶向目标mRNA的编码区,构建了抑制基因翻译的CRISPRi系统,发现hfCas13X能够显著抑制靶标基因的表达。然而,由于hfCas13X具有旁切活性,导致细胞生长受到明显抑制(图2)。随后,通过失活hfCas13X的核酸酶活性(dhfCas13X),消除了hfCas13X的旁切活性;进一步通过优化crRNA的结合位点和dhfCas13X的表达水平,使CRISPRi系统的抑制效果达到11.1倍(图3)。
其次,将dhfCas13X与翻译起始因子IFs或RNA结合蛋白Hfq融合,构建了可激活基因翻译的DiCRISPRa (Degradation-inhibited CRISPRa)系统,其中,crRNA能够靶向核酸酶识别位点,阻止mRNA的降解,从而激活下游基因的表达(图4)。为进一步增加激活效果,设计构建了TsCRISPRa (Translation-started CRISPRa)系统,在Trigger crRNA的引导下,dhfCas13X-hfq能够打开靶标mRNA 5’-UTR处的Switch结构,激活mRNA的翻译,激活效果达43.2倍(图5)。最后,将构建的CRISPRi/a系统应用于2’-岩藻糖基乳糖(2’-FL)和核黄素代谢网络的全局调控,使它们的产量分别提高1.2倍和3.0倍(图6)。相关研究为翻译水平的基因表达调控提供了新工具,也为CRISPRa系统的构建提供了新思路。
上述研究工作得到了国家自然科学基金青年基金(32200050)、国家自然科学基金面上项目(32070085、32021005)等项目的资助。
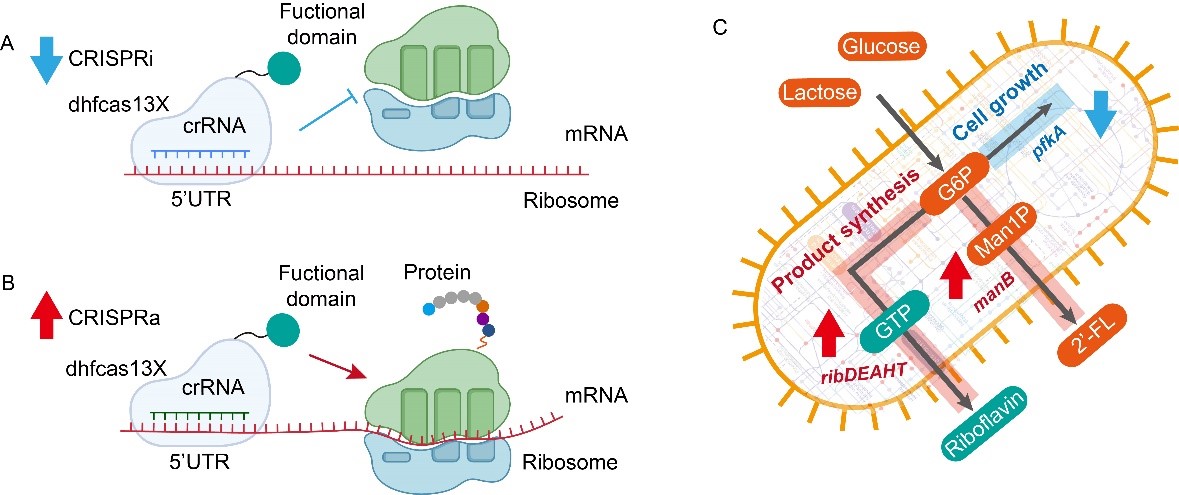
图1 基于dhfCas13X的CRISPRi和CRISPRa调控系统示意图
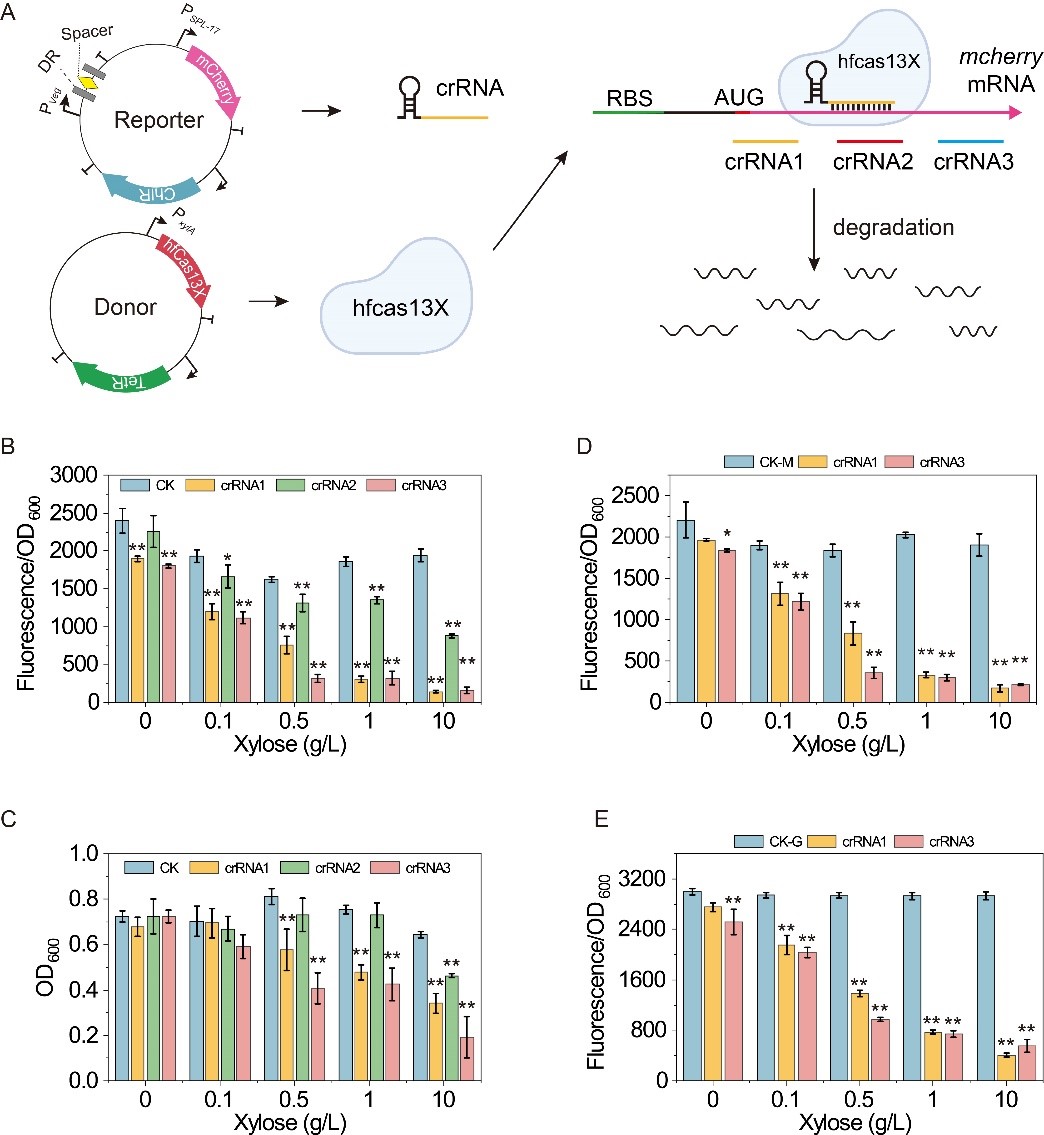
图2 hfCas13X在B. subtilis中的功能测试
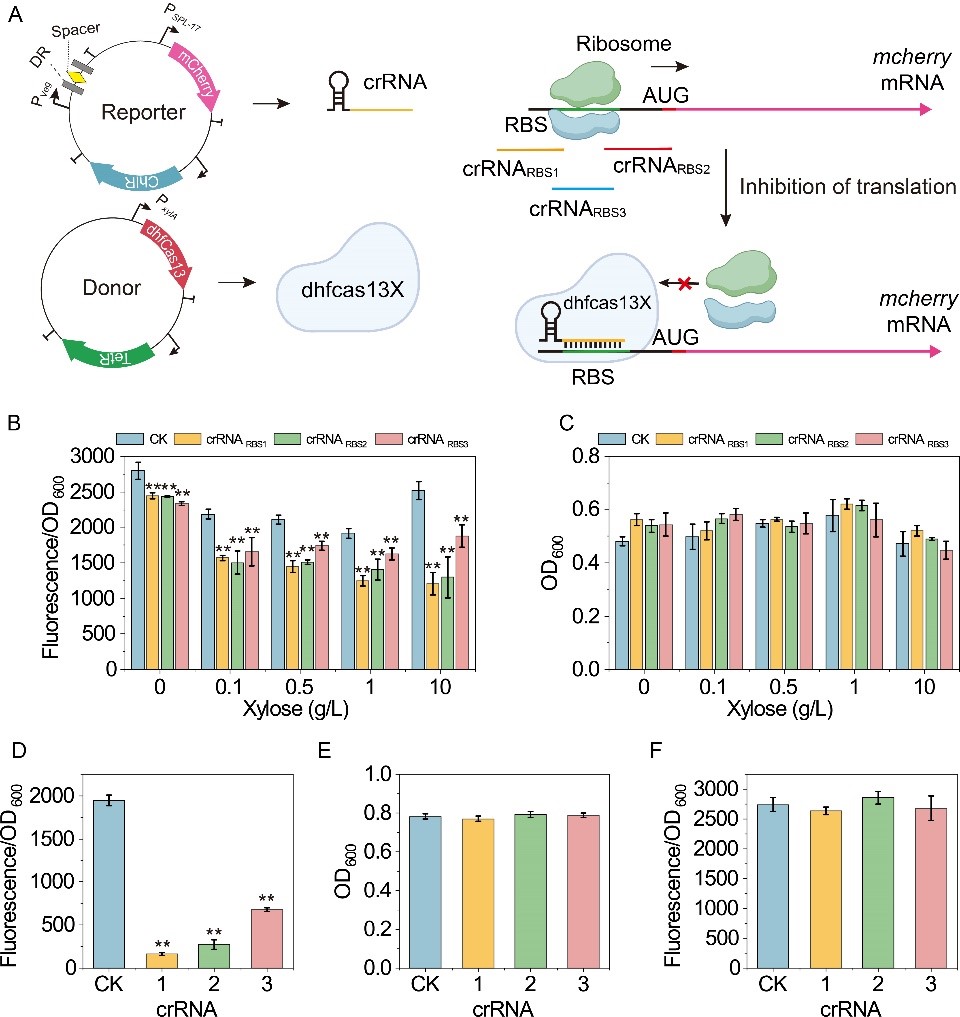
图3 基于dhfCas13X的CRISPRi系统构建和表征
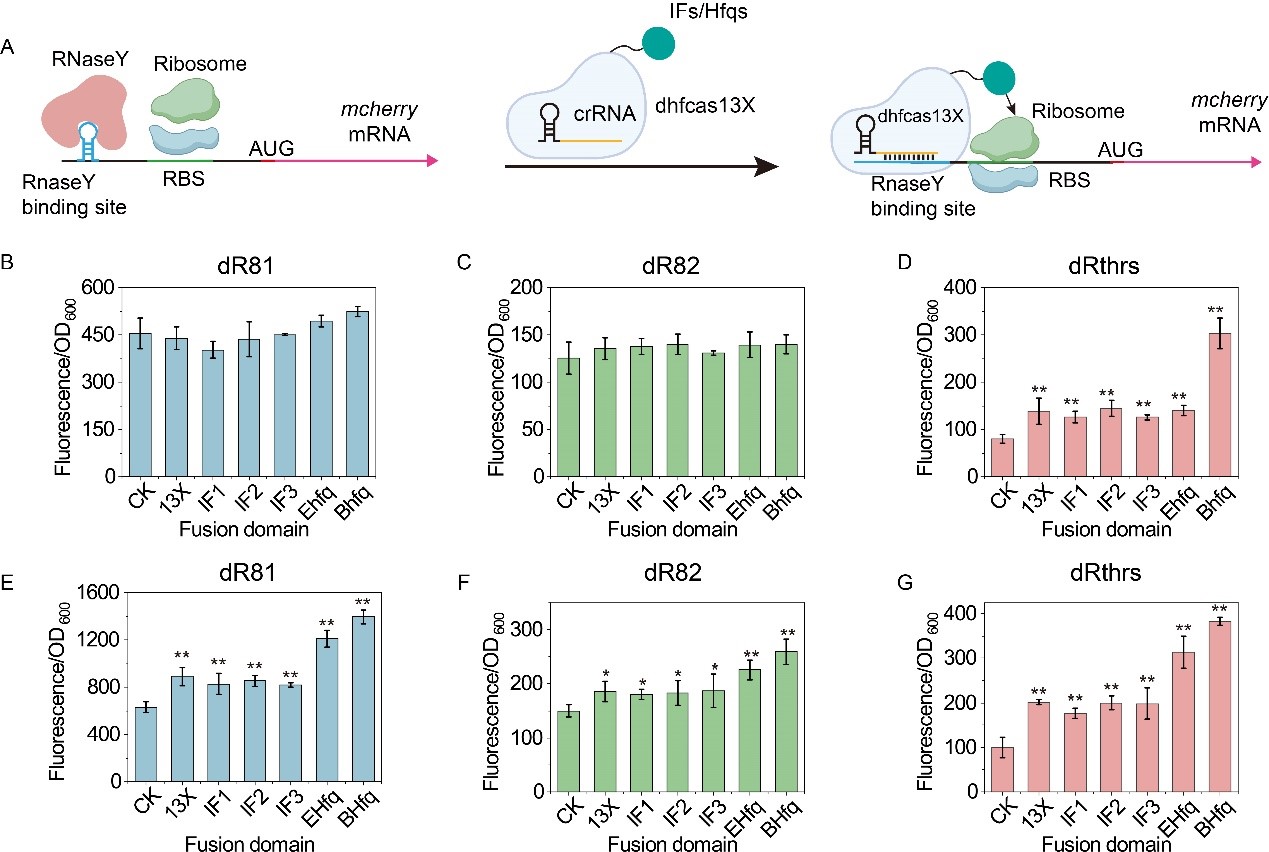
图4 DiCRISPRa调控系统的构建和表征
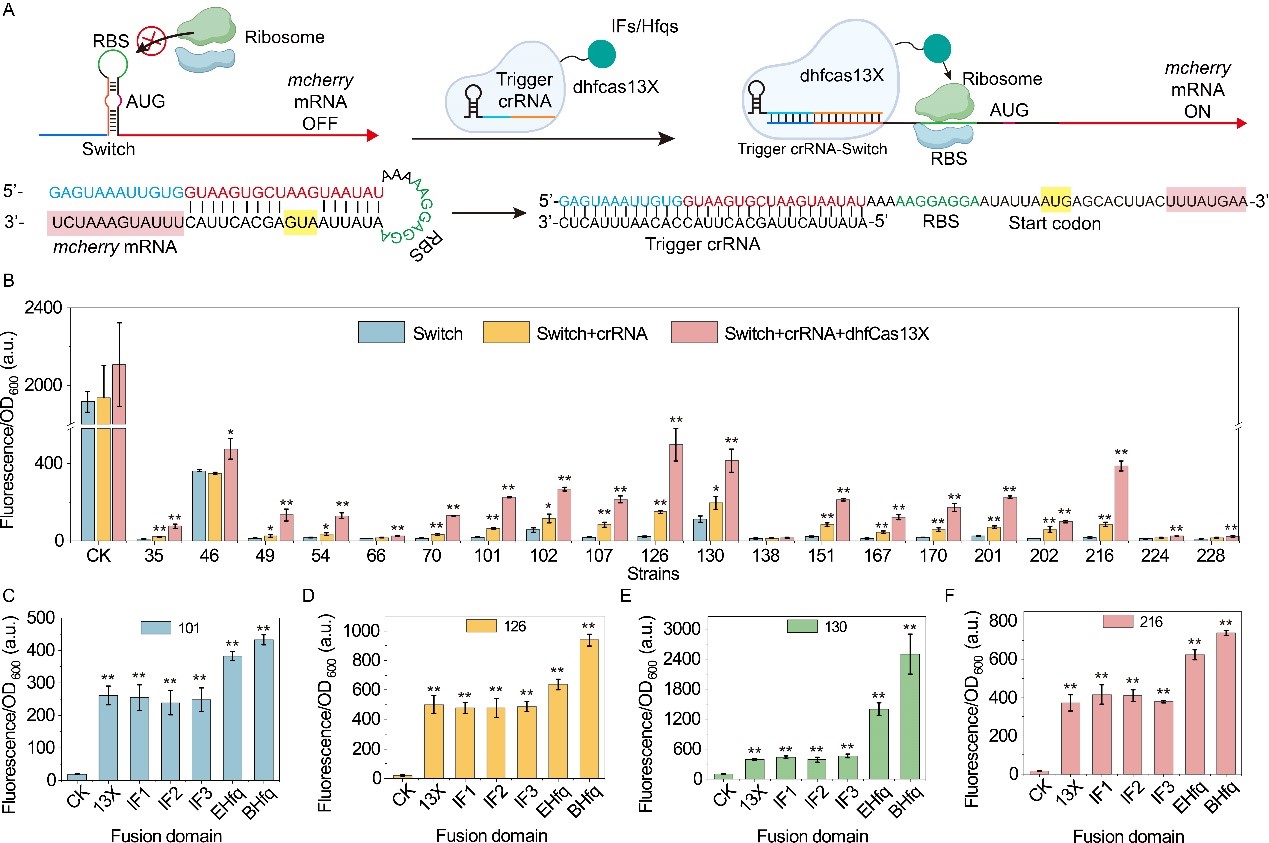
图5 TsCRISPRa调控系统的构建和表征
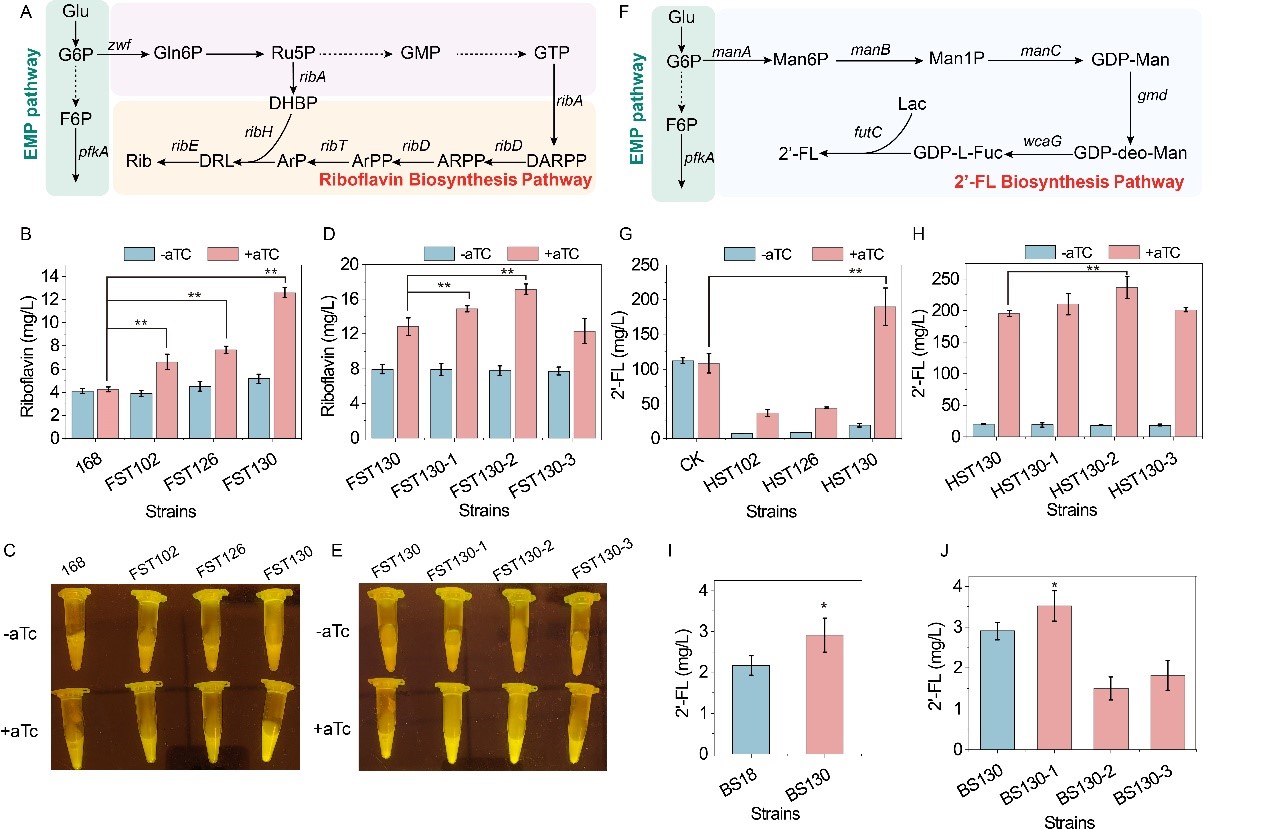
图6 基于CRISPRi/a系统的核黄素和2’-岩藻糖基乳糖代谢网络调控
