近期,我校生物工程学院糖化学与生物技术教育部重点实验室李子杰副教授课题组在L-鼠李糖异构酶的定向进化和D-阿洛糖合成中取得重要进展,研究成果“Enhancing the Catalytic Efficiency of L-Rhamnose Isomerase for D-Allose Synthesis through Simultaneous Engineering of Noncatalytic and Catalytic Pockets”正式发表于Journal of Agricultural and Food Chemistry (中科院一区、Top期刊,IF = 5.7) (https://doi.org/10.1021/acs.jafc.5c01858)。
D-阿洛糖是一种在食品、制药和医疗保健等行业具有重要应用价值的稀有糖。最常见的生产D-阿洛糖的方法是由L-鼠李糖异构酶(L-RI)催化D-阿洛酮糖转化合成。然而,该酶催化合成D-阿洛糖的效率相对较低。基于此,本研究以一种来源于Clostridium stercorarium的L-RI为研究对象,通过对其非催化口袋和催化口袋中的关键氨基酸进行突变,得到了催化效率远高于野生型的组合突变体,最后将其在枯草芽孢杆菌中进行了重组表达,测试了其合成 D-阿洛糖的性能,为工业生产D-阿洛糖提供了一种有潜力的高效生物催化剂。
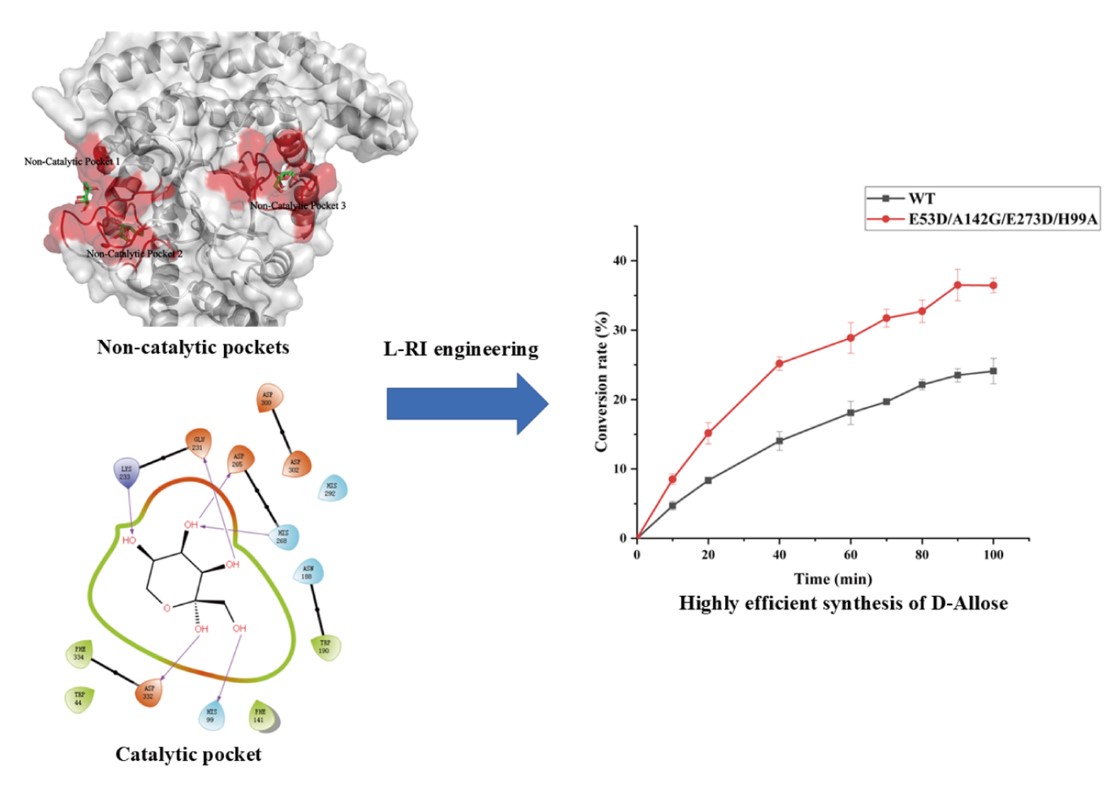
本研究围绕L-RI催化D-阿洛糖合成的关键机制展开系统性探究。首先,基于L-RI中β1-α1-loop的动态开合特性,分别利用SWISS-MODEL和AlphaFold构建了两种同源结构模型,并结合分子动力学模拟详细解析该loop的构象变化过程。结果表明,在生理反应条件下,β1-α1 loop更倾向于维持开放状态,为底物结合创造有利条件。为提升L-RI的催化性能,通过对非催化口袋改造,优化底物结合位点,提高底物D-阿洛酮糖进入催化口袋的效率以及催化口袋中底物的局部浓度;同时对催化口袋进行针对性改造,优化关键氨基酸残基与底物的相互作用模式。研究发现,野生型L-RI中His99残基侧链不仅形成空间位阻,阻碍D-阿洛酮糖进入催化活性中心,还限制 β1-α1 loop的构象转换。当将His99替换为Ala后,空间位阻降低,显著提升了L-RI的催化活性。通过上述分子改造,成功获得催化效率提升173%的组合突变体。最后将该组合突变体在枯草芽孢杆菌中进行重组表达,并探究了全细胞转化的最适条件,为工业化生产D-阿洛糖提供了一种安全高效的方法。
李子杰副教授为论文通讯作者,我校2022级硕士研究生沈立群为第一作者。上述研究得到了国家自然科学基金(32171475)项目资助。
近年来李子杰课题组在稀有糖的生物合成及生物催化领域取得了丰硕成果,相关研究发表在Journal of Agricultural and Food Chemistry (2025、2022、2020a、2020b、2019)、Communications Biology (2023)、International Journal of Biological Macromolecules (2025、2024)、Food Bioscience (2025)、Biotechnology Journal (2024)等本领域权威期刊。
