近日,我校生物工程学院中西秀树教授团队在溶酶体分泌调控截短甘露糖型N-聚糖的细胞膜表达方面取得重要进展,研究成果“MYO18B promotes lysosomal exocytosis by facilitating focal adhesion maturation” 正式发表于Journal of cell biology(Q1,IF=7.4,https://doi.org/10.1083/jcb.202407068),JCB官网对该成果进行了推介。
溶酶体是细胞内的细胞器,主要功能是分解核酸、蛋白质、脂质和碳水化合物等生物大分子。除了消化功能外,溶酶体还参与了诸多重要的细胞活动,例如营养感知和代谢的中心。其中,溶酶体分泌 (lysosomal exocytosis) 是一个动态过程,涉及溶酶体与质膜的融合,从而释放溶酶体中的酶和其他可溶性货物,并将溶酶体膜蛋白暴露于细胞表面。溶酶体分泌是对多种细胞膜损伤的普遍反应,例如病原体感染、细菌孔形成毒素和机械损伤。除了对外部刺激的反应,溶酶体分泌可以在没有外部刺激的情况下发生。例如,在秀丽隐杆线虫 (Caenorhabditis elegans) 中,侵袭性细胞利用溶酶体分泌穿透基底膜。某些癌细胞通过溶酶体分泌排出多余的质子,以适应酸性微环境。此外,新冠病毒 (SARS-CoV-2) 利用溶酶体分泌离开宿主细胞。这些研究表明,细胞具有内在机制来启动溶酶体分泌,但这些机制仍未被充分研究。
为了阐明上述机制,本研究首先在三种人类细胞系(HeLa、人单核白血病细胞THP-1、人胚肾细胞HEK293)中进行了糖蛋白质组分析。分析检测到分别来自HeLa、THP-1和HEK293细胞的202、133和189种糖蛋白。大部分截短型甘露糖蛋白源自溶酶体 (61.7%),包括溶酶体膜蛋白(如LAMP1)和可溶性蛋白(如PSAP)。为了验证截短型甘露糖的生成机制,作者在HeLa细胞中分别敲除HEX α和β亚基基因 (HEXA 和 HEXB)。敲除这些基因后,截短型甘露糖前体与最终截短型甘露糖的比例显著上升,表明溶酶体内的HEX在截短型甘露糖生成中发挥了重要作用。
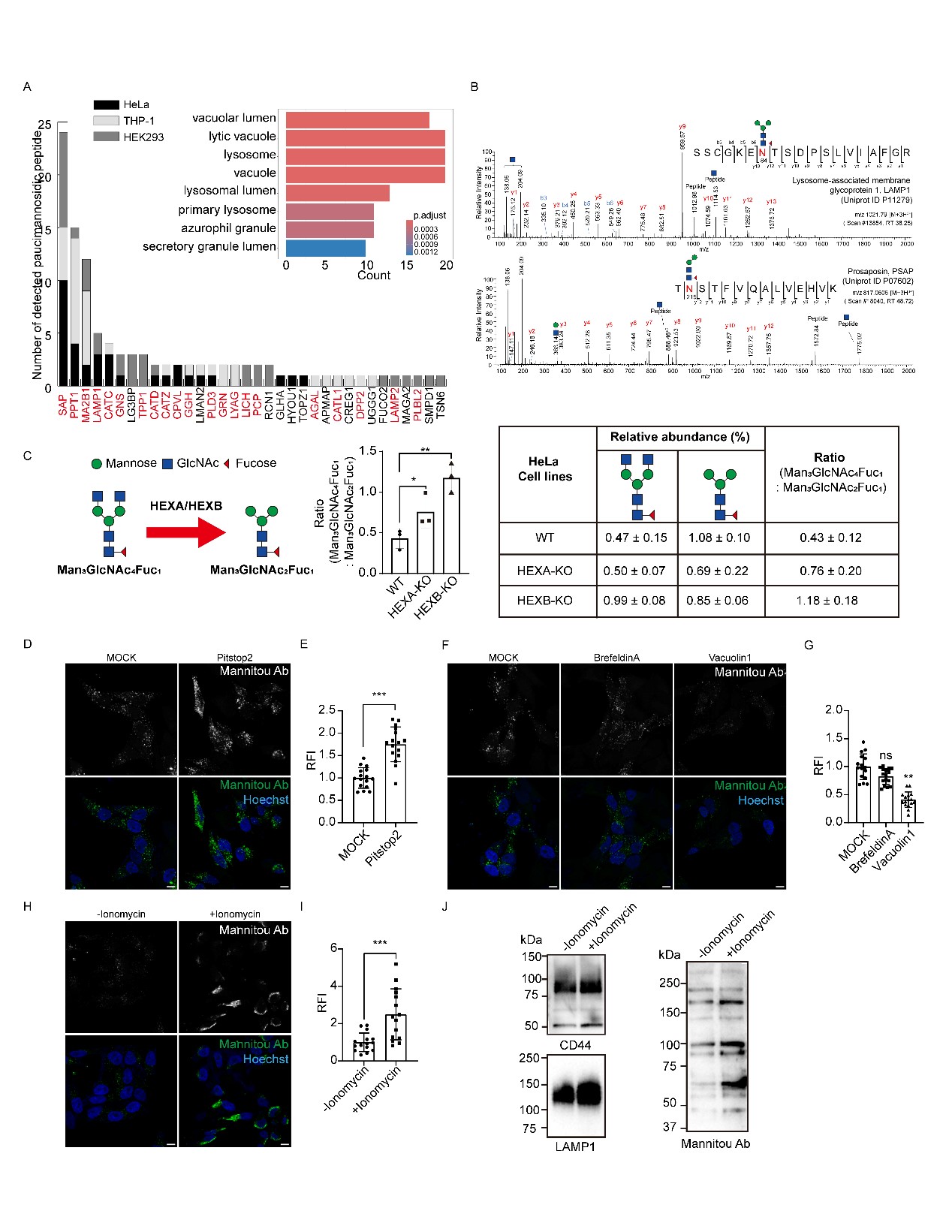
图1 溶酶体HEX催化的截短型甘露糖通过溶酶体分泌暴露于细胞表面
随后,通过CRISPR/Cas9的全基因组敲除筛选,发现在MYO18B敲除的细胞中,LAMP1的细胞表面水平显著降低;而重新表达EGFP标记的MYO18B后,LAMP1的表达水平得到了恢复。此外,溶酶体酶HEX的分泌在MYO18B敲除细胞中显著减少,这进一步表明溶酶体分泌在MYO18B缺失的情况下受到抑制。通过一种基于细胞膜修复的实验(使用溶血素O诱导膜损伤),作者发现MYO18B敲除细胞修复膜损伤的能力显著下降,而恢复MYO18B表达后,这一能力得到了部分恢复。这表明MYO18B在溶酶体分泌过程中起着重要作用(图2)。为了直接监测溶酶体分泌,本研究使用了VAMP7-pHluorin融合蛋白。pHluorin在溶酶体内的酸性环境中荧光被淬灭,但当溶酶体与质膜融合时,内外pH值中和,导致荧光发射。在野生型(WT)细胞中,观察到了频繁的溶酶体融合事件。然而,在MYO18B敲除(KO)细胞中,使用该方法观察到溶酶体与质膜的融合事件显著减少。这些观察结果进一步支持了MYO18B作为溶酶体分泌正调节因子的作用(图3)。
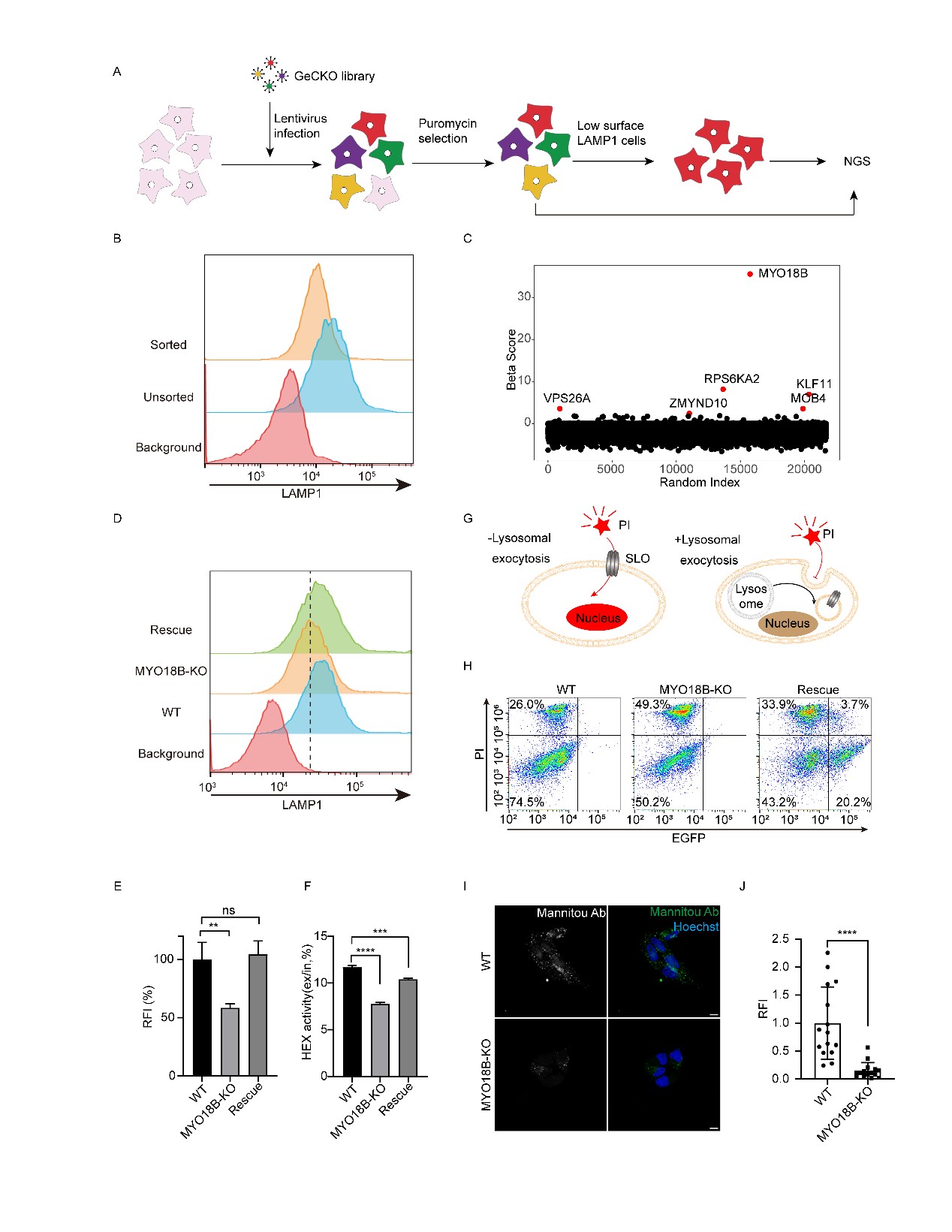
图2 基因组全基因敲除筛选确定MYO18B为溶酶体分泌的关键调节因子
在该项研究中,观察到MYO18B敲除(KO)HeLa细胞的细胞质中出现了明显的细薄肌动蛋白纤维积聚,而野生型(WT)细胞则没有这种现象。MYO18B敲除细胞的迁移能力明显减弱。黏着斑(FAs)在细胞迁移中起着至关重要的作用,通过作为细胞外基质(ECM)与细胞内肌动蛋白细胞骨架之间的动态连接,FAs使得细胞能够通过肌动蛋白-肌球蛋白的收缩力对ECM施加力量,这对于细胞体的牵引运动至关重要。本研究通过免疫荧光显微镜分析了WT和MYO18B-KO细胞中的黏着斑。在MYO18B-KO细胞中,黏着斑适配蛋白vinculin的荧光点较小,定量分析显示,大型黏着斑(>0.5 µm²)的数量显著减少,表明FA成熟受损。在MYO18B敲除的U2OS细胞中也观察到了类似的黏着斑成熟缺陷。
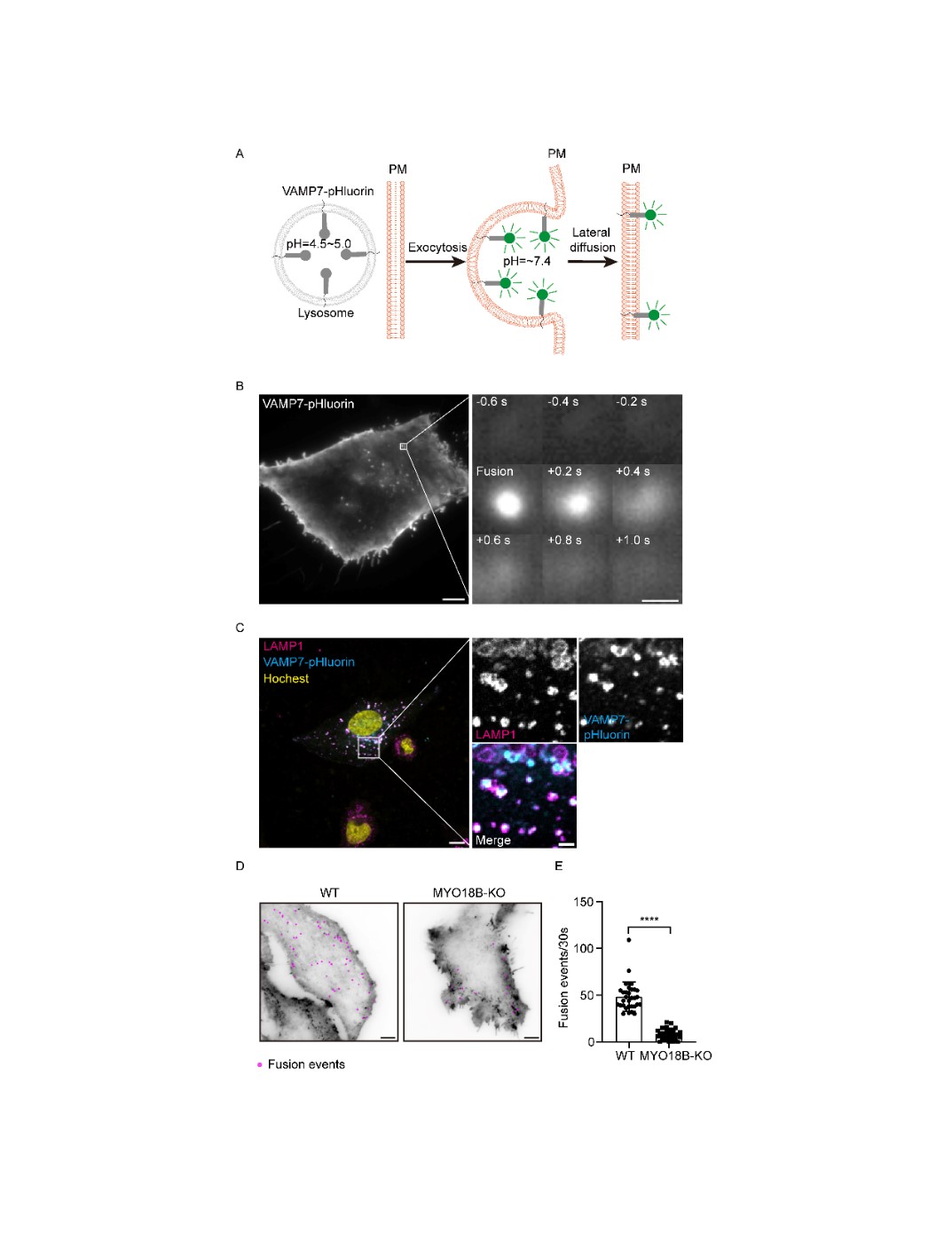
图3 MYO18B-KO细胞中溶酶体分泌受损
MYO18B是一种非常规的肌球蛋白,由2,567个氨基酸残基组成。其中心区域,跨越氨基酸残基555至2,089,展示了肌球蛋白II的典型结构,包括一个由于氨基酸替换而功能失活的马达域、两个IQ结构域(促进与肌球蛋白轻链的相互作用)和一个对于同源二聚体形成至关重要的卷曲螺旋结构域。MYO18A和MYO18B是肌球蛋白XVIII家族的成员,具有相似的中心区域,但N端和C端有所不同。MYO18A有三种亚型:MYO18Aα(广泛表达)、MYO18Aβ(在造血细胞中表达)和MYO18Aγ(在心脏和骨骼肌中表达)(Taft和Latham, 2020)。为了研究MYO18A是否具有与MYO18B类似的功能,本研究在HeLa和U2OS细胞中敲除了广泛表达的MYO18Aα亚型。出乎意料的是,与MYO18B-KO细胞不同,MYO18Aα-KO细胞的细胞表面LAMP1水平与野生型细胞相当。敲除MYO18Aα实际上增强了溶酶体分泌,而不是抑制它且溶酶体分泌发生在黏着斑(FAs)附近(图4)。
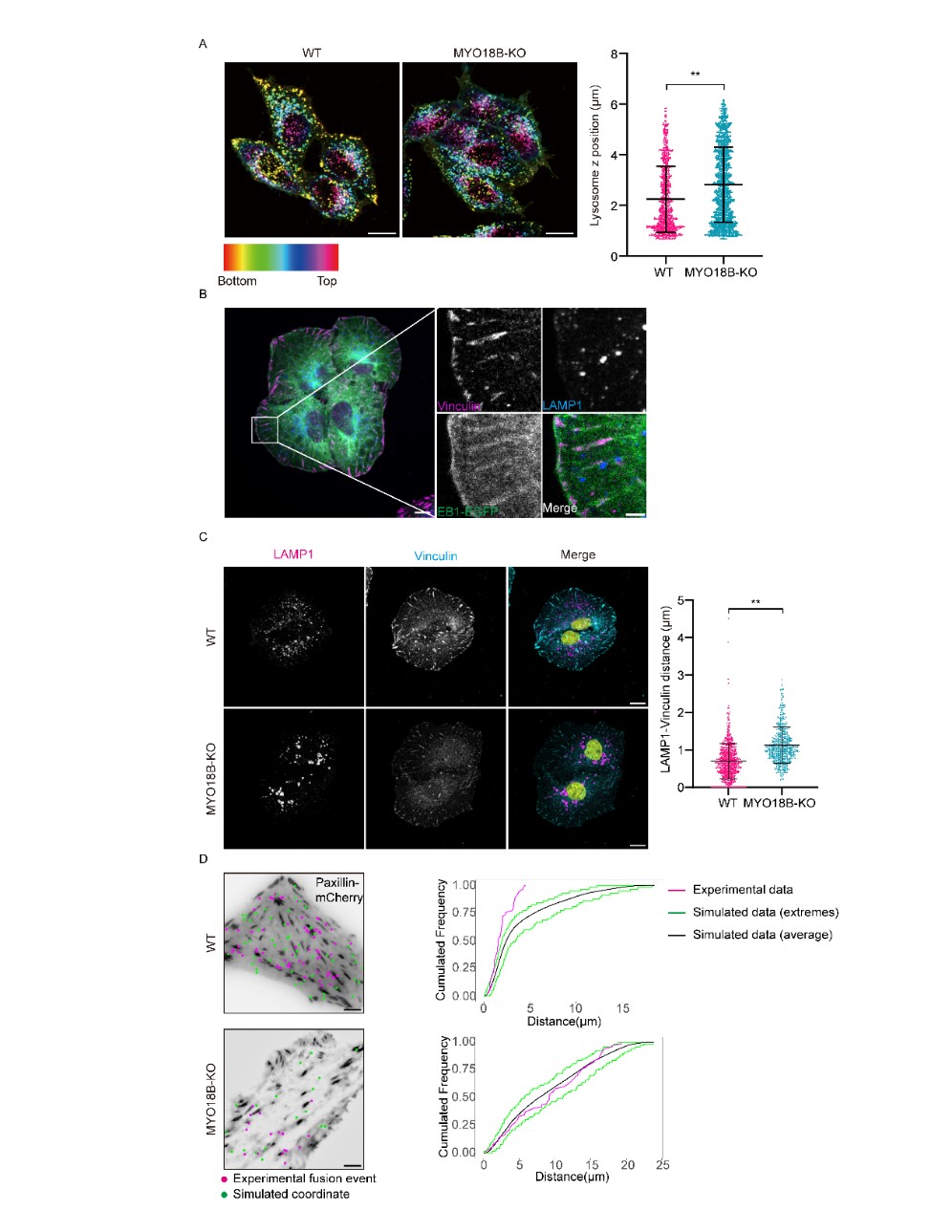
图4 溶酶体分泌发生在黏着斑附近
由于Ca²⁺信号对溶酶体与质膜的融合至关重要,本研究采用了一个融合蛋白,该蛋白结合了Ca²⁺传感器RCaMP6和FAK的FAT结构域,用于检测FA处的局部Ca²⁺水平。荧光显微成像结果显示,RCaMP6-FAT探针形成了盘状的点状模式,表明它成功地被招募到FA处。在MYO18B敲除(KO)HeLa细胞中,RCaMP6-FAT的荧光点大小减小,且与野生型(WT)细胞相比,荧光强度下降,这表明在缺乏MYO18B的情况下,FA处的局部Ca²⁺浓度下降(图5)。
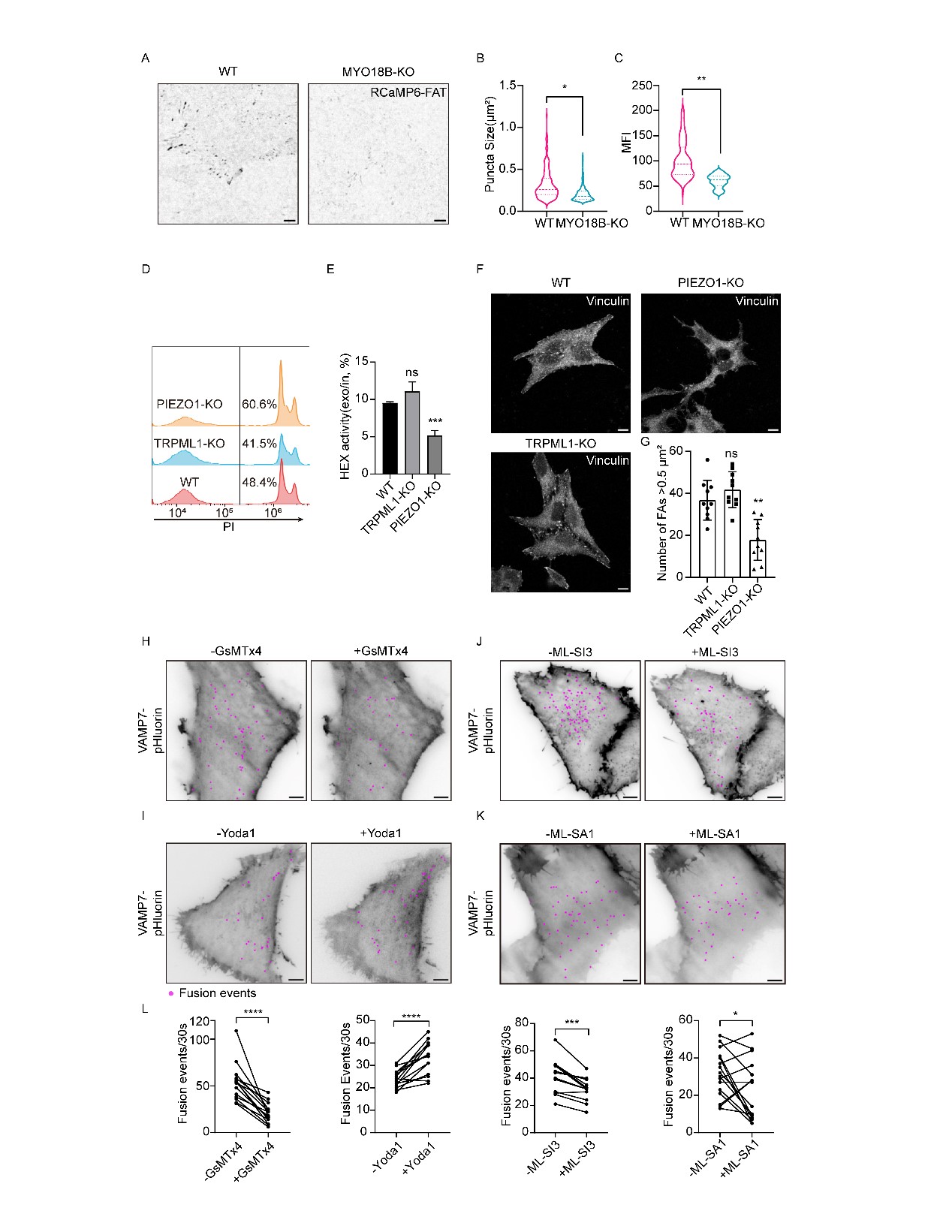
图5 MSC PIEZO1导入Ca²⁺触发溶酶体与质膜的融合
总之,本研究展示了由溶酶体糖苷水解酶(包括HEXA和HEXB)生成的、由截短型甘露糖修饰的蛋白质,这些蛋白质属于一种研究较少的截短型N-糖链,并通过溶酶体分泌暴露于细胞表面。通过全面的基因组敲除筛选,本研究确定了MYO18B作为这一过程的关键调节因子。此外,本研究还发现,溶酶体分泌主要发生在黏着斑(FAs)附近,而不是随机分布在质膜上。作为一种肌动蛋白交联蛋白,MYO18B本身促进压力纤维的组装,这对于FA成熟至关重要。溶酶体分泌精确地局限于FA附近,归因于两个主要因素:溶酶体向FA的靶向运输,这一过程依赖于微管和FA的相互作用;以及MSC(如PIEZO1)的激活,这些通道在FA处被局部激活,导入外源Ca²⁺,这一Ca²⁺对于溶酶体与质膜的融合是必不可少的(图6)。
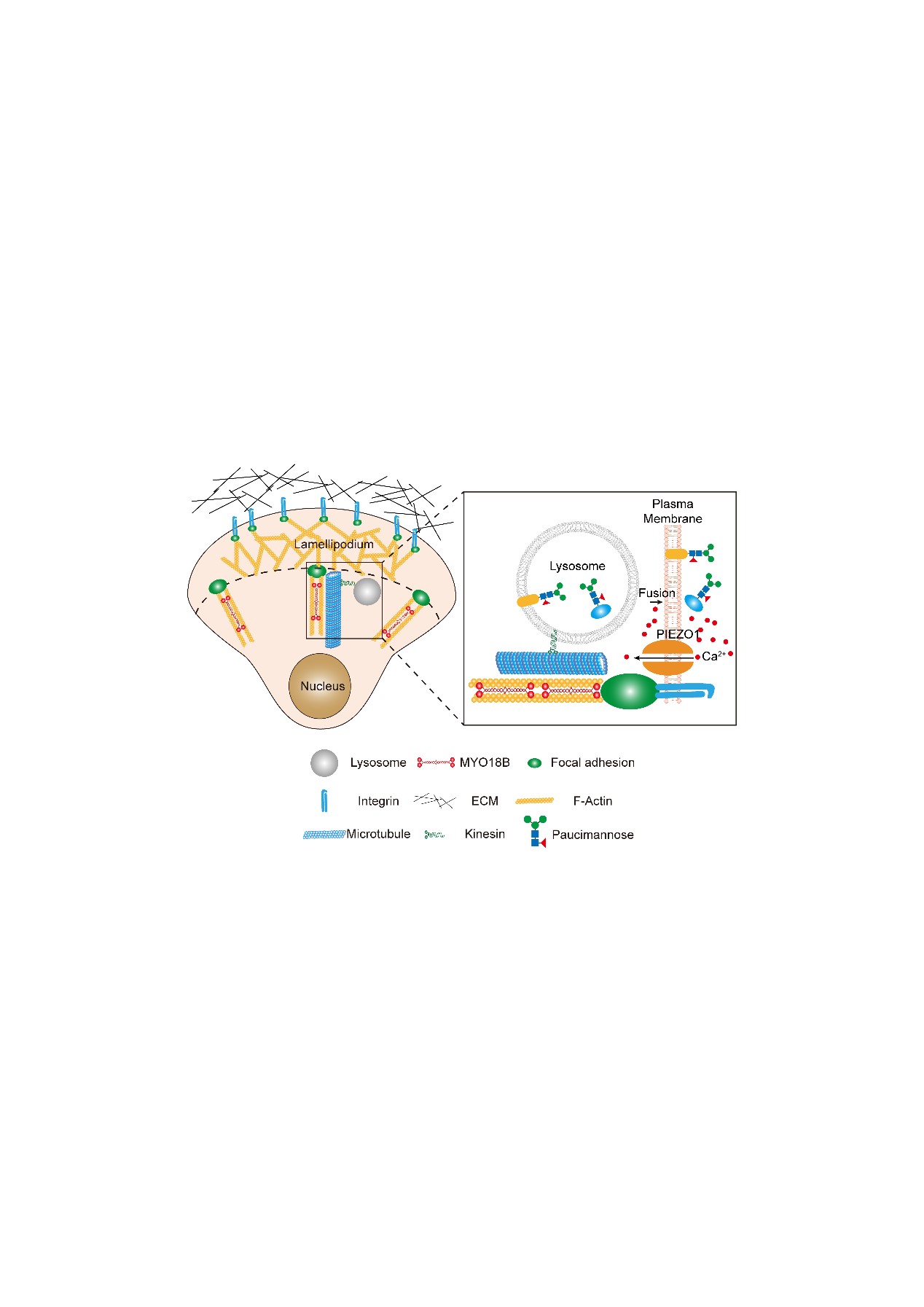
图6 MYO18B促进溶酶体分泌的机制
生物工程学院2019级博士研究生任伟伟为论文第一作者,江南大学生物工程学院原教授藤田盛久教授为论文的通讯作者。上述研究得到了国家自然科学基金面上项目(32071278)的资助。
