近日,ACS Catalysis在线发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队周景文教授课题组的研究成果“Simplification of Corticosteroids Biosynthetic Pathway by Engineering P450BM3” (Chen et al., ACS Catal. 2024, 14, 4117-4129)。江南大学2022级博士陈启航为论文第一作者,周景文教授为论文通讯作者。
皮质类固醇(Corticosteroids)是由肾上腺皮质产生的类固醇,氢化可的松(Hydrocortisone)和皮质酮(Cortexolone)等皮质类固醇物质因具有丰富的羟基化修饰使其成为治疗过敏、皮炎和肾上腺功能障碍等疾病的理想选择。黄体酮(Progesterone)是皮质类固醇的主要碳骨架,其可以经葡萄糖作为底物在微生物宿主从头合成得到,因此被认为是合成氢化可的松等皮质类固醇的“绿色”底物。传统的黄体酮合成氢化可的松生物途径为三步反应,至少需要6种酶共表达,多酶表达和复杂的酶级联反应限制了氢化可的松的高效合成。此外,黄体酮中因存在丰富的惰性C-H键,在不产生过多副产物的情况下利用P450实现对其骨架的精准单一或多重羟基化修饰在合成生物学中同样是一项艰巨的任务之一。因此,需要设计新的P450催化元件,丰富类固醇的区域选择性羟基化位点,简化黄体酮合成氢化可的松的合成步骤,进而实现皮质类固醇高效生物合成。
针对上述问题,江南大学食品合成生物学与生物制造团队研究人员基于计算模拟指导改造了P450BM3并用于黄体酮合成皮质酮再合成氢化可的松的两步合成途径中。第一步合成:以野生型P450BM3(Bacillus megaterium来源)出发,逐步通过B-Factor指导的底物通道改造、重塑heme中心口袋和自由能计算指导的heme中心口袋柔性化的三代精细化酶工程,最终获得了VD16-BM3、VD17-BM3、VD21-BM3和VD1721-BM3可以分别高效区域选择性羟化黄体酮的C16β、C17α、C21和C17α/21,值得注意的是VD1721-BM3可以将黄体酮合成皮质酮的步骤简化为一步单酶反应。第二步合成:需要获得高效催化元件羟基化修饰皮质酮的C-11位,首先分别验证了文献报道的CYP5311B2和LG23,其中CYP5311B2可以羟化修饰皮质酮的C-11β,其转化率和区域选择性分别为93%和91%,可以用于后续氢化可的松全细胞合成体系构建。CYP5311B2和LG23催化进程研究发现底物通道是影响P450羟化修饰甾体不同碳位的关键,因此基于底物通道切换策略,理性改造得到了FA11a-BM3可高效催化皮质酮合成11α-氢化可的松,转化率和区域选择性分别为85%和90%。分子动力学模拟揭示了heme中心口袋排斥底物残基的柔性化有助于目标羟化碳位稳定暴露于FE=O上方。最终,将开发的P450突变体用于构建高效的大肠杆菌全细胞催化体系,实现了从1 g/L黄体酮一锅生产11α/β-氢化可的松,摩尔转化率为81%和84%。本研究为简化甾体药物的生物合成步骤和生物催化剂提供了可行的策略。
上述研究工作得到了国家重点研发计划项目(2019YFA0905300)的资助。

图1 改造P450BM3底物通道提升黄体酮羟基化效率
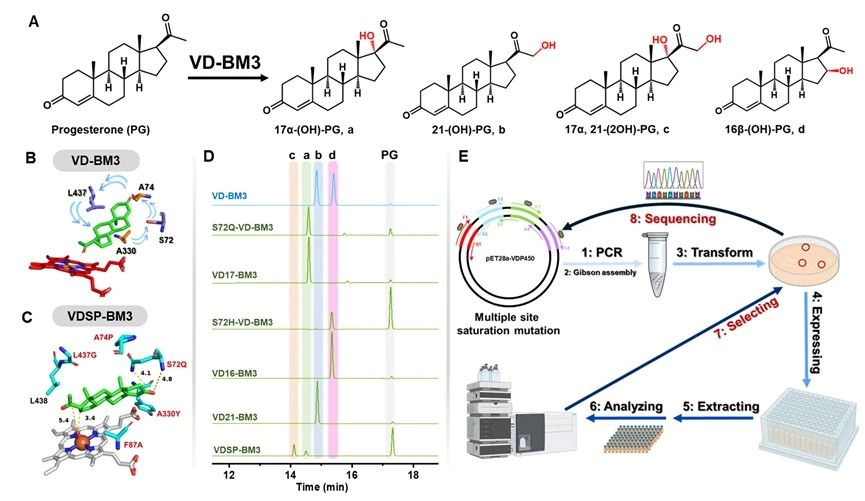
图2 P450BM3的heme中心口袋改造丰富黄体酮羟化碳位
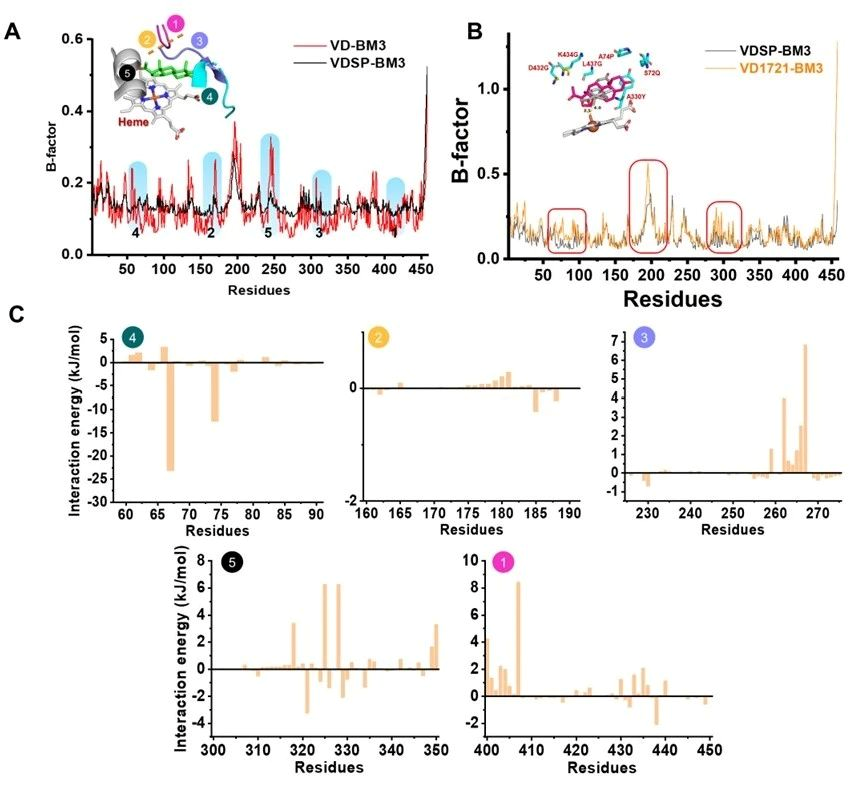
图3 自由能计算指导改造P450BM3提升C17/21双羟化转化率
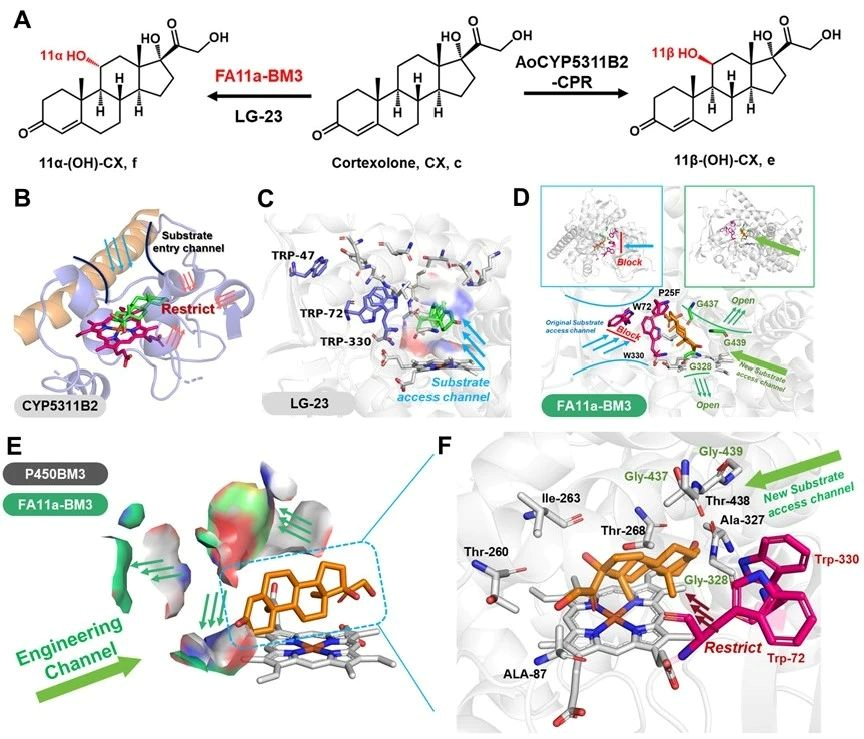
图4 底物通道切换策略实现皮质酮的C-11位羟化
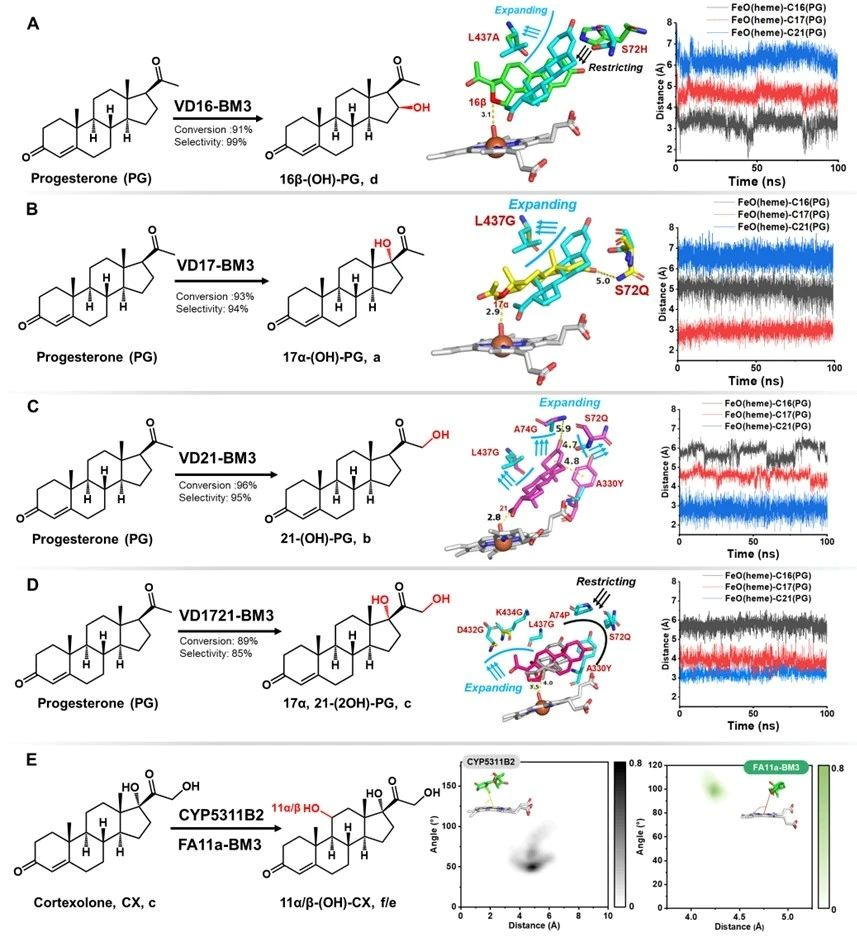
图5 分子动力学模拟揭示P450BM3突变体高效区域选择性羟化修饰机制
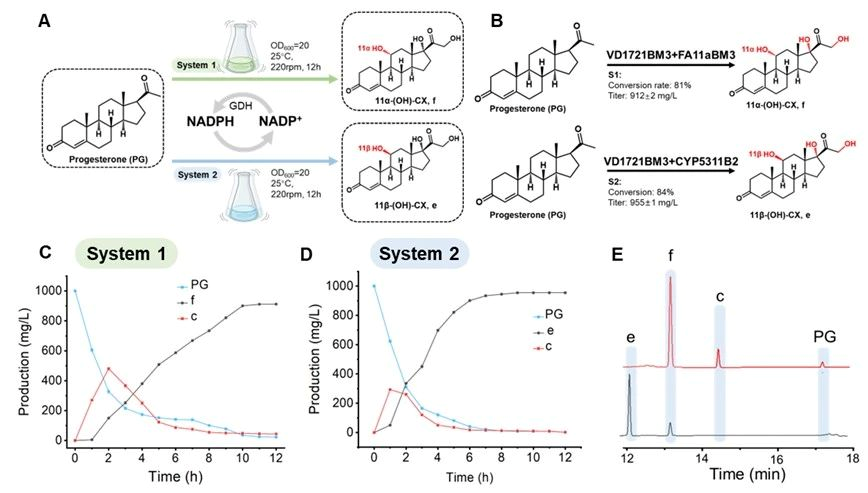
图6 构建全细胞催化体系转化黄体酮合成氢化可的松
