近期,我校生物工程学院许菲教授团队在同时设计高活性和热稳定性甲基对硫磷水解酶方面取得重要进展,研究成果“A Dual-Focus Workflow for Simultaneously Engineering High Activity and Thermal Stability in Methyl Parathion Hydrolase”在线发表于Angewandte chemie International Edition (IF =16.1) (https://doi.org/10.1002/anie.202410881)。
工业发酵生产需要在极端高温和pH值等恶劣条件下高效且稳定的酶,然而,由于天然酶受自然进化的限制,无法满足实际工业应用的条件,此外在设计天然酶来提高稳定性通常会导致催化活性的丧失,反之亦然,即所谓的活性-稳定性权衡,极大地限制了酶生物技术的发展。
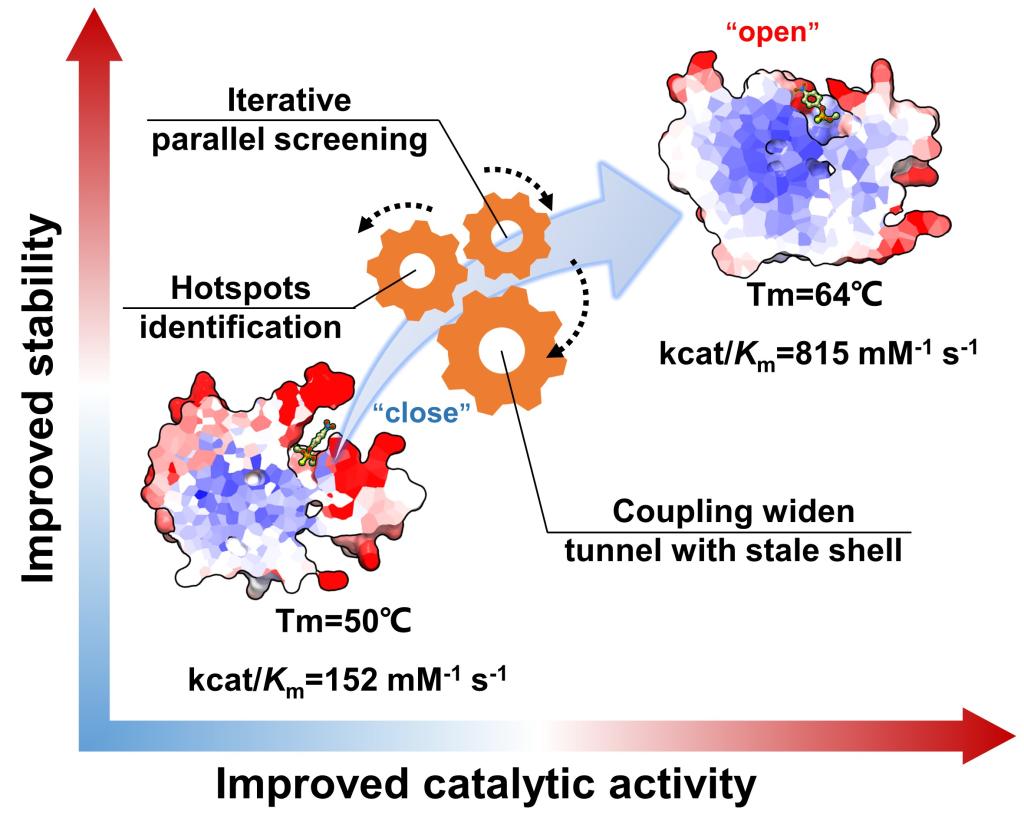
许菲教授团队以中温甲基对硫磷水解酶 (MPH)为模式酶,开发了一种双重聚焦的计算机设计流程,将定向进化和靶向突变的优势进行结合加速兼具高活性和耐热酶的开发。首先,为了预测热点突变位点,构建了一个与每个残基的目标特性相关的特征库,然后通过层次聚类算法对候选位点进行优先排序。随后使用多种算法模拟选择压力对候选位点进行计算机筛选,确定了七个表现优异的突变体。随后,探讨了通过组合多个突变以进一步提高MPH功能的可能性,通过多轮的平行迭代突变筛选成功地生成了具有更高稳定性和活性的甲基对硫磷水解酶复合突变体MPHase-m5b。该突变体与野生型MPH相比,表观熔融温度(Tm)提高高13.3°C,半衰期t1/2延长21.3分钟。此外,增强的酶热稳定性并没有以牺牲催化效率为代价,其中MPHase-m5b的催化效率在20-70℃温度范围下全面高于野生酶,且最高催化活力提高4.2倍。进一步通过蛋白质晶体学、QM/MM 计算和分子动力学模拟的深入分析表明,关键的第三壳层突变共同赋予了突变体 MPHase-m5b独特结构和动力学特征。其中,在内部,这些突变重塑了底物输送路径形态,扩大了底物进入活性位点的入口,从而提高了酶催化活力。在外部,突变驱动了蛋白质外壳残基之间的非共价相互作用数量的增加,增强了在较高温度下催化所需的结构完整性。本研究通过同时聚焦多种酶特性为克服传统工程权衡问题提供了一种的替代策略。同时,为开发更高效、更强大的商业生物催化剂提供了概念基础,以满足日益增长的工业和生物医学对高性能酶的需求。
许菲教授为论文的通讯作者,我校2019级博士研究生李英南为第一作者。上述研究得到了国家重点研发计划(2018YFA901601)、国家自然科学基金面上项目(22078129)等资助。
近年来许菲教授团队以合成生物学科学理论为指导,在蛋白质与多肽的计算设计、制备与性能研究方面取得丰硕成果,相关研究成果已发表在Nature Communication (2022)、Journal of American Chemical Society (2013)、PNAS(2018) (2018)、Angewandte Chemie International Edition (2024)等本领域权威期刊。
