近期,聂尧教授课题组针对在手性药物成分合成中关键羰基还原酶的研究进展进行了系统综述,以“From discovery to application: enabling technology-based optimizing carbonyl reductases biocatalysis for active pharmaceutical ingredient synthesis”为题正式发表于Biotechnology Advances(IF=12.1)(https://doi.org/10.1016/j.biotechadv.2024.108496)。
手性醇化合物是一类光学活性的模块化化合物。基于模块化化合物的结构特征,带有各种取代基和官能团的手性醇化合物是关键活性药物的中间体。全球手性化学品市场规模预计到2026年将达到1332亿美元。羰基还原酶介导的生物催化不对称还原反应是合成手性醇的重要途径。然而,现有的羰基还原酶的应用范围仍然有限,这种缺陷主要是由于缺乏具有所需特征的可用酶,如底物范围受限、立体选择性不足、不稳定和副产物的产生。上述现状激发了人们对新型酶、高效酶工具箱和创新合成路线的研究。对此,文章从“发现新酶—蛋白质工程—辅酶循环体系-工业应用”四个角度出发,综述了基于序列-结构-数据集的多种使能技术。
文章首先概述了三类羰基还原酶的催化机制,以及如何通过序列挖掘、结构挖掘和代谢数据库来发现具有所需性质的新型天然酶。在蛋白质工程方面,分别针对短链还原酶、中链还原酶、醛酮还原酶的典型结构,总结了活性口袋中的“通用热点”以及基于多米诺效应的远端关键位点,并分析了这些热点突变引起的功能变化背后的结构动力学机制。随后展开了对酶重设计和从头设计方面新策略新技术的讨论。在构建辅酶循环体系方面,除了传统的底物偶联法和酶偶联法,还详细讨论了涉及光催化的辅酶再生策略及其局限性。分别针对手性中心的数量,综述了不同高附加值活性药物成分合成中涉及到的羰基还原酶工业化应用。以前,酶工程遵循“You get what you screened”原则,但现在实现了“You get what you designed”。随着机器学习等计算机辅助技术的进步,羰基还原酶将在手性化合物的制备中发挥更重要的作用,有助于相关传统化学过程的绿色转型。
聂尧教授为本文的通讯作者,2024级博士后顾洁为论文第一作者。本项工作得到国家重点研发计划(2021YFC2102000)、国家自然科学基金(22178147, 22378168)等项目的联合资助。
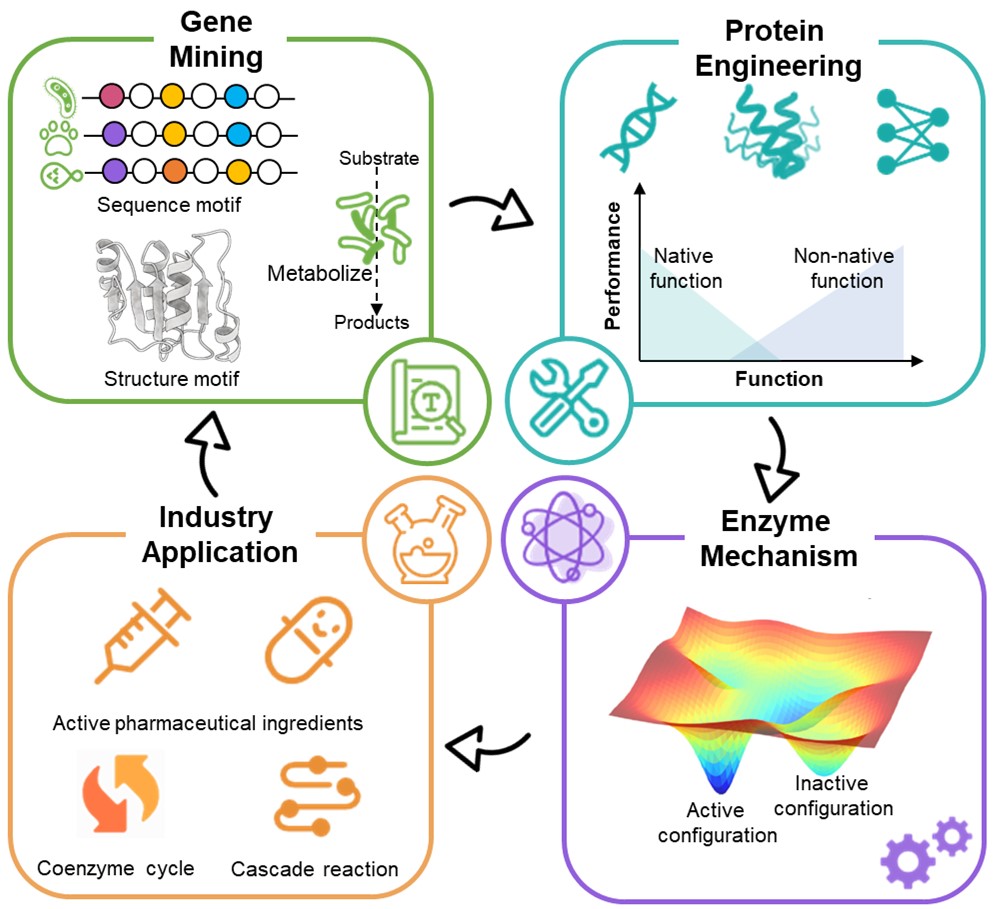
图 从挖掘到应用:基于使能技术优化羰基还原酶生物催化活性药物成分的合成
