近期,我校生物工程学院丁重阳教授课题组针对食药用真菌多糖生物合成精细调控的研究进展进行了系统综述,以“Refined regulation of polysaccharide biosynthesis in edible and medicinal fungi: From Pathways to production”为题正式发表于“Carbohydrate Polymers”(IF = 10.7)(https://doi.org/10.1016/j.carbpol.2025.123560)。
食药用真菌多糖是一类结构复杂、具有多种生物活性的天然高分子,广泛应用于免疫调节、糖脂代谢干预及肠道菌群重塑等健康领域。本文从“复杂结构构建机制、多糖合成机制、精准调控策略”三个维度,系统总结了食药用真菌多糖合成调控的最新研究进展与关键技术。
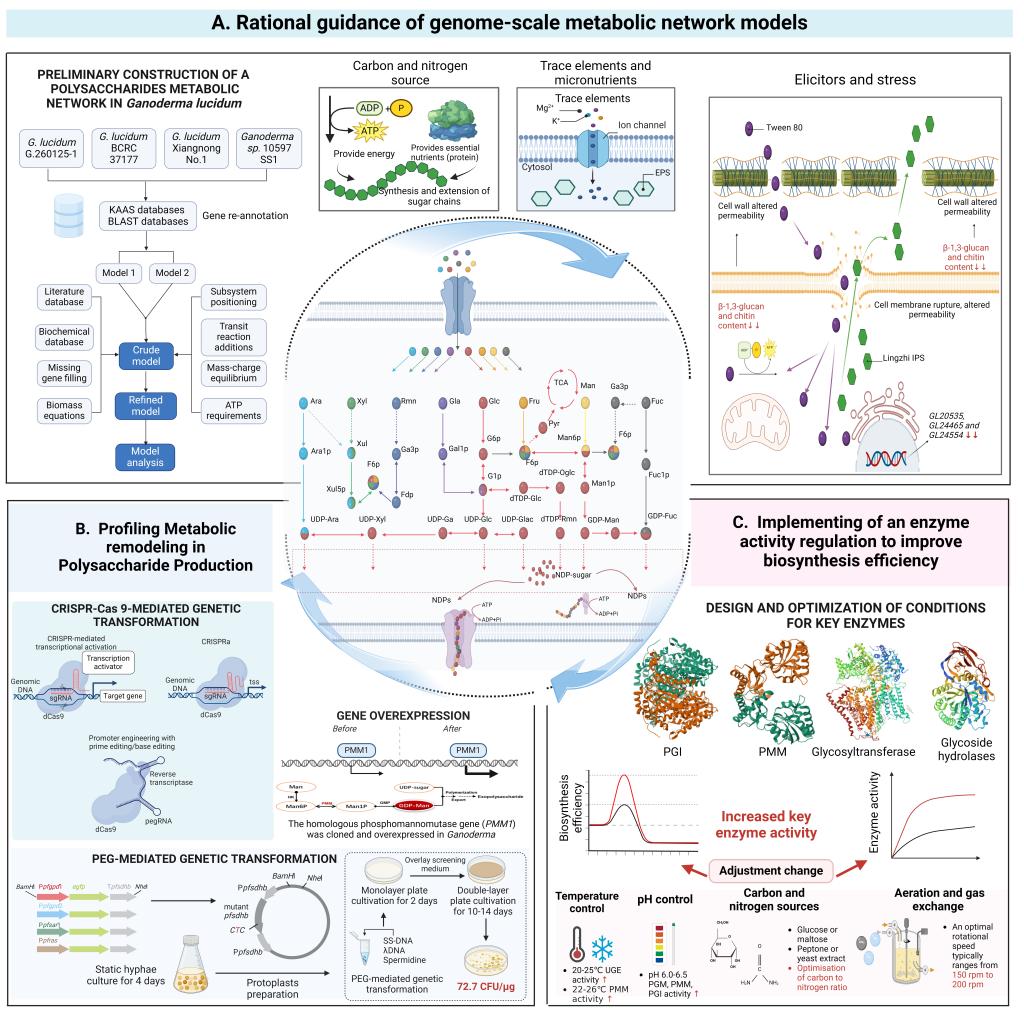
在合成机制层面,系统归纳了食药用真菌多糖合成过程中关键酶的类型及功能,包括磷酸葡萄糖变位酶、尿苷二磷酸葡萄糖焦磷酸化酶、葡萄糖-6-磷酸异构酶等糖供体生成相关酶,以及直接决定糖苷键连接方式的糖基转移酶(GTs);依托基因组尺度代谢建模,结合转录组与代谢组多组学数据,提出了面向特定结构的合成通路优化策略;总结了催化效率提升与底物特异性重构的方法,为实现结构可控、多样化多糖合成提供理论支撑。在遗传调控层面,尽管CRISPR/Cas9等新一代工具在模式真菌中取得良好应用,但受限于真菌细胞壁屏障、感受态发生条件苛刻以及宿主应激响应等因素,在食药用真菌中仍面临遗传转化效率低、表达体系不稳定等难点;构建高效、广谱适用的食药用真菌遗传转化体系不仅是提升目标基因表达与功能验证效率的关键,更是推动食药用真菌多糖研究向“功能导向-结构可控-平台化表达”协同发展的技术基础。
糖基转移酶作为决定多糖结构构型与分支方式的关键酶类,因其种类繁多、底物专一性强,被认为是实现多糖结构精准构建的“最后一块重要拼图”。不同GTs家族成员在糖苷键类型、连接位点与供体识别机制上存在显著差异,其功能的精确性直接影响多糖主链排列、侧链修饰及空间构象的稳定性。当前,GTs及其同工酶在食药用真菌的动态表达以及对多糖合成的功能调控规律尚不明晰,尤其是其与上游糖供体合成及下游装配机制的耦合仍缺乏系统性认知。深化对糖基转移酶催化机制与代谢网络互作的研究,建立基于结构域识别的功能预测模型,实现对糖基转移酶的精准理性改造,是推动食药用真菌多糖结构精准设计与合成的关键步骤。
2022级博士郭玉曦和2024级博士后徐萌萌为论文的共同第一作者,丁重阳教授为论文的通讯作者。本项目得到国家自然科学基金(32272283)等项目资助。
近年来,丁重阳教授课题组在食药用真菌天然产物与酶资源的挖掘与应用上取得一系列原创性研究成果,部分成果已发表在ACS Catalysis(2024)、Carbohydrate Polymers(2025,2021)、Food Hydrocolloids(2024,2023)、Journal of Hazardous Materials(2023)、Trends in Food science & Technology(2021)、Food Chemistry(2025)等本领域权威期刊。
