近期,我校生物工程学院赵群教授团队成功将非天然的氮宾迁移反应机制引入金属酶催化体系,实现了酶促法合成手性非天然氨基酸,研究成果以“Directed Evolution of a Nonheme Iron Enzyme to Access Chiral α-Amino Acid Derivatives by 1,3-Migratory Nitrene C(sp3)─H Insertion为题正式发表于Angewandte Chemie International Edition(IF = 17),该工作入选Angewandte当期的 “Hot Paper”。

酶在漫长的自然进化中形成了高度专一的催化功能,但也隐藏着催化混杂性,在特定条件下能够催化非天然反应。非血红素铁酶在催化非天然反应中已经展现出巨大潜力,包括碳氢叠氮化、碳氢氟化、双健双官能团化、Diels─Alder环加成,Michael加成等多种非天然反应。
基于金属氮宾反应机制,本研究对1,3-氮宾迁移类型的反应进行了考察。研究人员对实验室的金属酶库进行筛选,获得了对模型反应的初始活性,在确定反应的产物结构和反应的对映体选择性后,发现Arabidopsis Thaliana 来源的Leucoanthocyanidin Dioxygenase(AtLDOX)野生型酶,对该模型反应表现出较好的催化性能(39%产率、92/8对映体选择性)。于是,研究人员选择该酶作为起点进行后续定向进化。
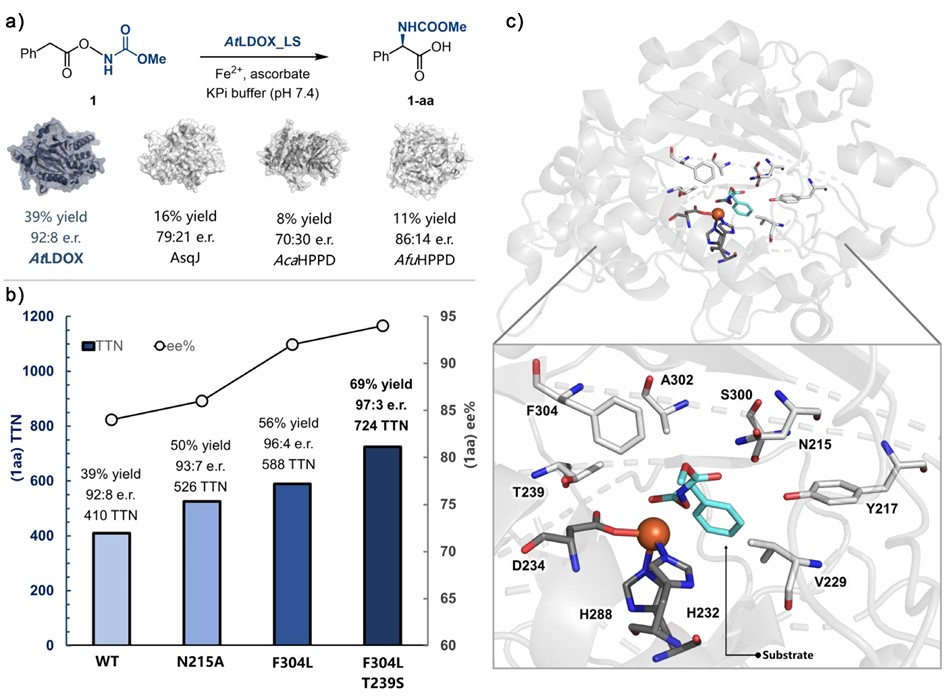
通过分子对接等手段,研究人员确定了在底物结合口袋的多个结合位点进行突变,最终发现突变体(AtLDOX_FL)对反应表现出优异的催化活性和立体选择性。工程化改造后的LDOX不仅能够适用于催化多种取代基的芳香族底物(卤素/甲氧基/甲基等取代基),还能够适配如噻吩等的杂环体系,这些底物均能以较高收率和对映体选择性转化为相应的手性α-氨基酸衍生物,产率高达81%,TTN高达808,对映体选择性高达98/2。本研究利用定向进化策略改造非血红素铁酶,实现了立体选择性控制的1,3-氮宾迁移反应,为手性非天然α-氨基酸衍生物的合成提供了新的酶催化途径。
我校2024级硕士生研究生程明辉和李涛为本文共同第一作者。上述工作得到了江苏合成生物学基础研究中心(资助编号BK20233003)、中央高校基本科研业务费(JUSRP202504019和JUSRP202501048)、无锡市科技发展基金项目(K20241034)的资助。
