近期,我校生物工程学院饶志明教授团队在大肠杆菌高效合成L-苏氨酸方面取得重要进展,研究成果“Engineering Escherichia coli for L-threonine hyperproduction based on multidimensional optimization strategies”正式发表于Journal of Agricultural and Food Chemistry (IF = 5.7) (DOI: 10.1021/acs.jafc.4c07607)。
L-苏氨酸作为一种必需的营养氨基酸,广泛应用于动物饲料中,以提高肉质,降低养殖成本,在氨基酸市场中占有巨大的市场份额。随着合成生物学和基因编辑技术的快速发展,通过系统代谢工程对微生物进行重编程以高效地产生目标化学物质已经取得了重大成就。近年来,利用多模块重编程策略在野生型大肠杆菌中实现了L -苏氨酸的过量生产。 但与 L-赖氨酸和 L-谷氨酸相比,目前的生产水平仍有差距。因此,开发具有工业化潜力的 L-苏氨酸细胞工厂将带来巨大的经济价值。
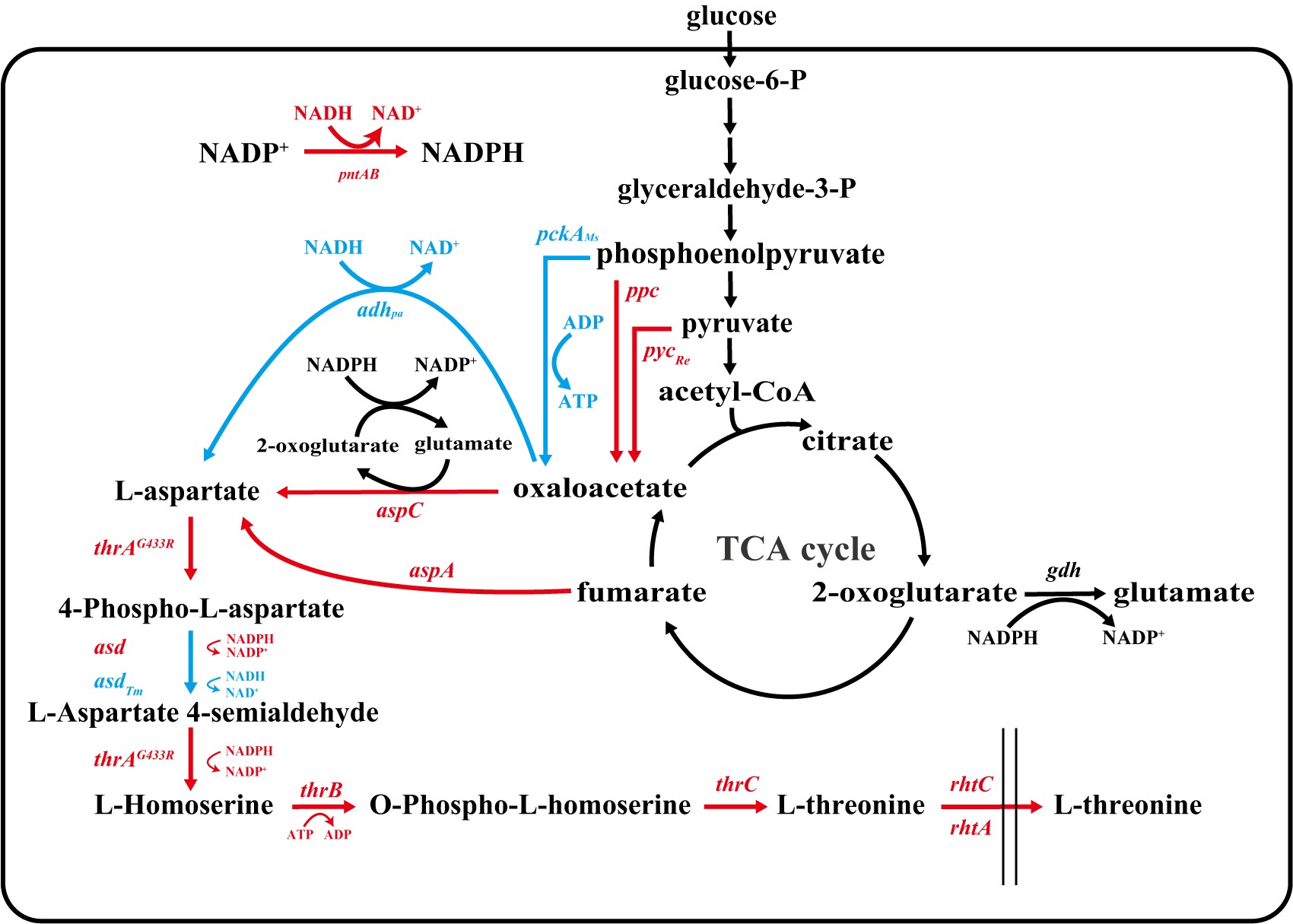
饶志明教授团队首先对苏氨酸合成途径限制步骤进行了验证,发现过表达NADH偏好性的天冬氨酸半醛脱氢酶(Asd)以及天冬氨酸脱氢酶(Adh)来协同利用辅因子NADH和NADPH合成L-苏氨酸,以及引入异源磷酸烯醇丙酮酸羧激酶(Pck)增强ATP的供给可以促进L-苏氨酸的生产。然后,引入活性降低的柠檬酸合成酶(GltA F383M)突变体,在保证细胞正常生长的状态下合理降低进入TCA循环的碳通量(降低CO2的排放),使更多的碳源通过磷酸烯醇式丙酮酸和丙酮酸(无碳源损失途径)生成草酰乙酸进而合成L-苏氨酸。随后,通过转录组学分析,比较大肠杆菌在有无外源添加L-苏氨酸时基因表达水平的变化,从中筛选并确定了应激响应全局调控因子UspA的过表达可以促进L-苏氨酸的产生。最后,通过引入抗逆性调节转录调控因子IrrE提高宿主的鲁棒性以及引入全局转录调控因子CRP R83F, G142P突变体解除高葡萄糖浓度下对Ptrc启动子转录水平的抑制,使得菌株的葡萄糖利用速率和L-苏氨酸产量进一步提高。在5L发酵罐中进行补料分批发酵验证THRH16菌株的L-苏氨酸生产性能,其在45h积累了170.3 g/L L-苏氨酸,糖酸转化率为0.625 g/g,生产力为3.78 g/L/h,是目前报道的最高L-苏氨酸生产指标,并且发酵过程无需添加抗生素以及诱导剂,本研究策略为提高其他化学品的生产提供了合理的指导。
饶志明教授为论文的通讯作者,我校2020级博士生赵振强为第一作者。上述研究得到了国家重点研发计划(2021YFC2100900)、国家自然科学基金(32071470)等资助。
近年来饶志明教授团队以合成生物学科学理论为指导,在系统开展高效合成高值化合物细胞工厂构建及产业化方面取得丰硕成果,相关研究成果已发表在Nucleic Acids Research (2024)、Science Advances (2020)、Nature Communication (2018)、ACS Catalysis (2018)、Advanced Materials (2018)、Biotechnology Advances (2023)、Metabolic Engineering(2022)、Bioresource Technology (2024)等本领域权威期刊。
