近期,我校生物工程学院陈坚院士团队关欣副研究员在Nature Reviews Bioengineering杂志在线发表了题为“Microbial cell factories for cost-effective and high-quality cultured meat”(Guan et al. Nat Rev Bioeng. 2024. https://doi.org/10.1038/s44222-024-00258-2)的评述文章,阐述了利用微生物细胞工厂这一前沿技术,破解细胞培养肉在成本控制和品质提升方面所面临的瓶颈,为细胞培养肉产业发展提供新思路。
细胞培养肉技术通过体外培养动物细胞而非传统动物养殖进行肉制品生产。这一生产过程不涉及动物的饲养和屠宰,因此相较于畜牧业养殖,它更安全可控、环保、高效且对动物友好。尽管目前细胞培养肉技术已取得一些突破,如可食用支架开发、细胞悬浮驯化和培养基循环等。然而,细胞培养肉的大规模工业化生产仍面临巨大挑战,其中最关键的是生产原料(如培养基和支架材料)的成本高昂以及产品品质的不足。
针对上述问题,陈坚院士团队提出“打造微生物细胞工厂,驱动细胞培养肉低成本、高品质生产”。通过代谢工程、合成生物学相关技术改造微生物,生产专用于细胞培养肉的原料和加工配料(图1),从而降低细胞培养肉生产成本、提高产品品质。为实现该目标,当前的微生物细胞工厂需要进一步升级,潜在的研究方向包括以下几个方面:
1)设计高性能细胞因子:细胞因子是无血清培养基中不可或缺的功能性添加剂,对于培养肉生产中动物细胞的增殖、分化和功能维持至关重要。目前,大多数细胞因子价格昂贵、稳定性较差,因此,开发高稳定性、高活性的细胞因子将提高其利用率并降低成本。近年来飞速发展的蛋白质工程技术,如定向进化、合理设计和AI蛋白质设计等,为获得具有更高产量、稳定性、特异性和生物活性的细胞因子提供了有效方法。
2)开发功能性水解物:微生物如酵母富含营养,经发酵和水解后可以获得含有多种营养物质的混合物,包括游离氨基酸、维生素和活性肽等。同时,可以进一步改造微生物,开发出含有功能性物质(如生长因子、胰岛素和白蛋白等)的复合水解物,其具有显著的成本优势。但值得注意的是,高浓度的水解物可能会抑制细胞生长,因此需要系统研究来识别和去除相关成分。
3)探索自定义功能支架:细胞支架构筑仿生三维微环境并提供机械支持,对细胞功能调节和组织形成至关重要,同时也是影响培养肉成本的重要因素。目前,采用代谢工程策略已实现了多糖类材料(如透明质酸、纤维素等)的微生物合成,但是在重组表达蛋白类材料(如全长胶原蛋白、明胶等)方面仍面临产量低、易降解、凝胶性能差等技术挑战。一个潜在的解决方案是利用重组技术,通过模块组合策略设计全新的生物材料,实现高生产效率和所需功能特性的兼得。
4)定制化生产食品配料:体外生产的纯细胞或组织通常是无色无味的,因此食品化加工是提高培养肉适口性和营养强化的关键环节。目前,微生物细胞工厂已实现了多种食品配料的生物合成,如酶制剂、着色剂和调味剂等。进一步,在系统解析细胞培养肉与传统肉品风味和营养差异的基础上,利用微生物细胞工厂为培养肉定制化生产食品配料。
通过构建和优化微生物细胞工厂,为细胞培养肉打造专属供应链,将极大地推动细胞培养肉的产业化进程。在开展技术研发的同时,还应开展食品安全研究,为产品审批和消费者认可提供科学数据。
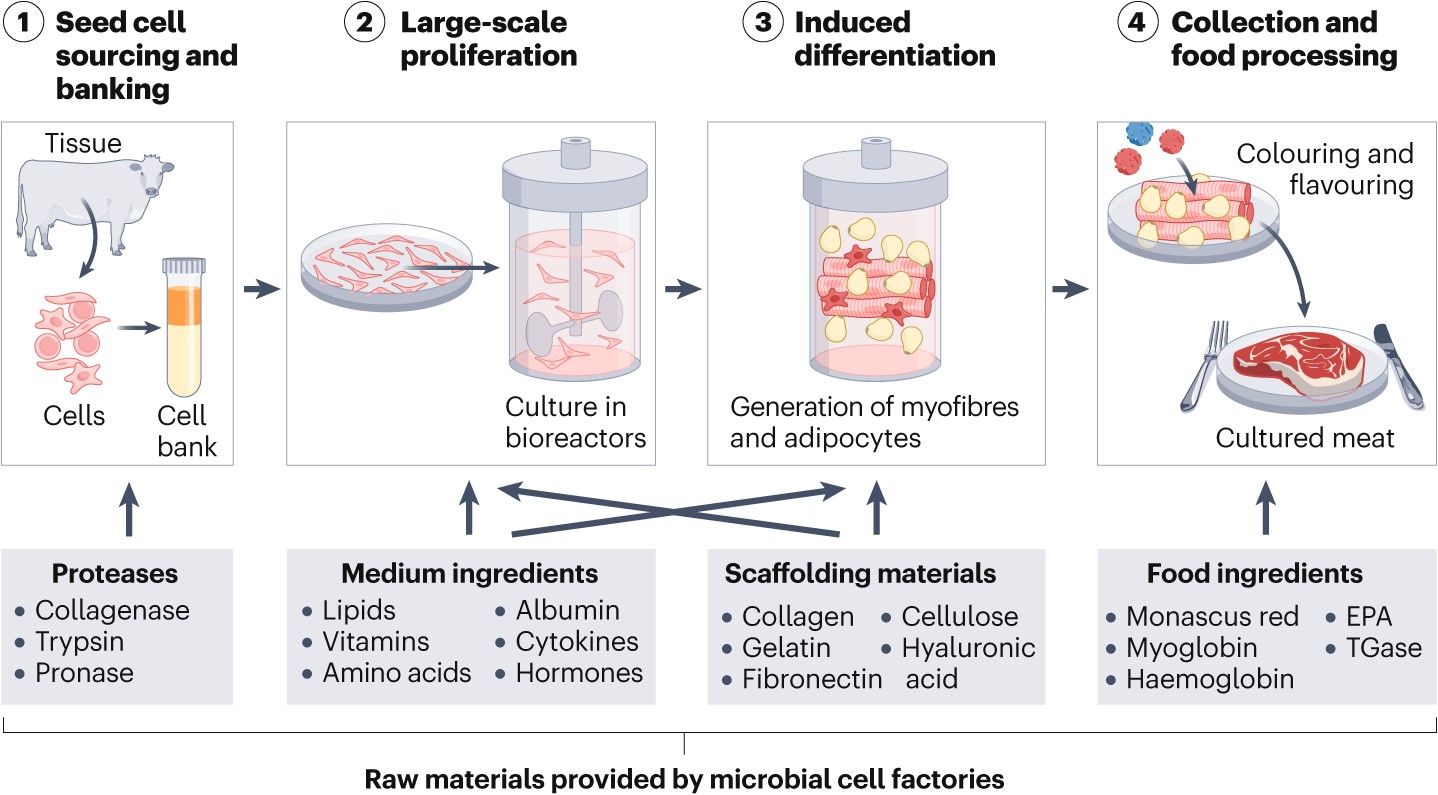
图1 使用微生物细胞工厂生产的原料进行细胞培养肉生产
上述研究得到了浙江大学上海高等研究院繁星科学基金(SN-ZJU-SIAS-0013)、中国工程院战略研究与咨询项目(2023-XZ-79)等的资助。
近年来陈坚院士团队以动物干细胞发育机理为理论指导,在动物肌纤维和脂肪细胞体外生成调控、组织构筑和细胞培养肉高效制备技术开发方面取得丰硕成果,相关研究成果已发表在Food Research International、Food & Function、Food Bioscience、Trends in Biotechnology、Future Foods等本领域权威期刊。
